下列现象或事实解释正确的是
| A.铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应 |
| B.铝热反应提供一定的能量引发,因为铝热反应为吸热反应 |
| C.增加炼铁高炉(右图)的高度并不能提高CO的转化率,因为化学平衡没有移动 |
| D.鸡蛋清中加入2滴1%醋酸铅溶液后产生沉淀,因为蛋白质发生了盐析 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
| A.由反应可确定:氧化性HClO3>O2 |
| B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
用0.2 mol/L Na2SO3溶液32 mL,还原含2×10-3mol X2O72-的溶液,过量的Na2SO3用0.1 mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1.6 mL,则元素X在还原产物中的化合价是
| A.+3 | B.+4 | C.+5 | D.+6 |
有下列三个氧化还原反应
①2FeCl3+2KI=2KCl+2FeCl2+I2
②2Fe+3Cl2=2FeCl3
③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是()
| A.KMnO4 | B.Cl2 | C.HCl | D.FeCl3 |
下列装置所示的实验不能达到目的的是 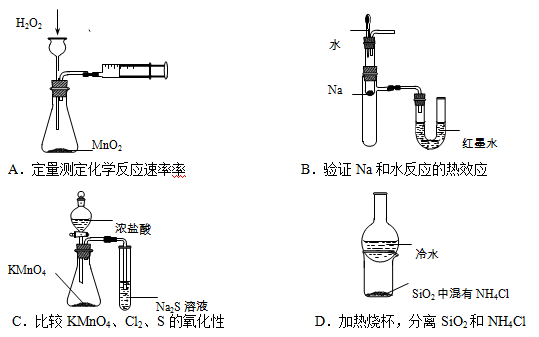
下列实验操作中,错误的是
| A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B.用100 mL容量瓶配制90mL1mol/L的NaOH溶液 |
| C.用pH试纸测得新制氯水的pH为2 |
| D.用酸式滴定管准确量取10.00mLKMnO4溶液 |