电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径 是同周期中 最小的。下列推断中正确的是 ( )
最小的。下列推断中正确的是 ( )
| A.Z的氢化物的热稳定性强于w的氢化物 |
| B.Z的氧化物与水反应可制得相应的含氧酸 |
| C.X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
| D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
| A.K1闭合,K2断开,铁棒上发生的反应为2H2O+O2+4e-=4OH- |
| B.K2闭合,K1断开,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
| C.K2闭合,K1断开,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K1闭合,K2断开,石墨棒周围溶液pH逐渐升高 |
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是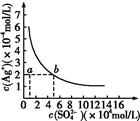
| A.含有大量SO42-的溶液中肯定不存在Ag+ |
| B.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
下列关于叙述正确的是
| A.室温下,浓度均为0.05mol/L的NaOH溶液和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12 |
| B.室温下,将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,2c(SO42-)>c(NH4+) |
| C.室温下,0.1mol/L的盐酸和0.1mol/L的氢氧化钡等体积混合,混合后溶液pH=7 |
| D.室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后的溶液pH>7 |
已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O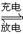 Cd(OH)2+ 2Ni(OH)2有关其说法正确的是
Cd(OH)2+ 2Ni(OH)2有关其说法正确的是
| A.充电过程是化学能转化为电能的过程 |
| B.放电时负极附近溶液的碱性不变 |
| C.放电时电解质溶液中的OH—向正极移动 |
| D.充电时阳极反应:Ni(OH)2-e-+ OH-= NiOOH+H2O |
根据热化学方程式:S(s)+O2(g)=SO2(g)ΔH=akJ·mol—1,分析下列说法中错误的是
| A.S(s)在O2(g)中燃烧是放热反应 |
| B.S(g)+O2(g)=SO2(g)ΔH=bkJ·mol—1,则a<b |
| C.1mol SO2(g)所具有的能量低于1molS(s)与1molO2(g)所具有的能量和 |
| D.16g固体硫在空气中充分燃烧,可放出a/2kJ的热量 |