四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:① v(A)=" 0.15mol/(L·s)②v(B)=" 0.6mol/(L·s) ③v(C)= 0.4mol/(L·s)
④v(D)= 0.45mol/(L·s)。其中,反应进行得最快的是 ( )
A.① B.② C.③ D.④
向0.1 mol·L-1的CH3COOH溶液中加入CH3COONa晶体或加水稀释时,均会引起()
| A.溶液的pH都增加 | B.CH3COOH电离程度增大 |
| C.溶液导电能力都减弱 | D.溶液中c(OH-) 都减小 |
下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )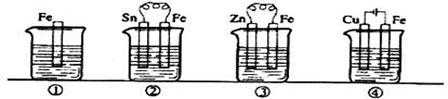
| A.③>②>④>① | B.②>①>③>④ | C.④>②>③>① | D.④>②>①>③ |
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是()
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.②④ | B.②③ | C.①② | D.③④ |
向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-)。其平衡关系如下:
Cr3++3OH- Cr(OH)3
Cr(OH)3 CrO22- + H+ + H2O
CrO22- + H+ + H2O
(紫色)(灰绿色)(亮绿色)
向0. 05mo1·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是()
| A.溶液为紫色 | B.溶液中有灰绿色沉淀 |
| C.溶液为亮绿色 | D.无法判断 |
下列实验基本操作正确的是()
| A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL; |
| B.配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量 |
| C.用广范PH试纸测某 溶液PH=3.6 |
| D.用玻璃棒蘸取溶液滴到湿润的pH试纸上,测其pH |