下列过程都与热量变化有关,其中表述不正确的是( )
| A.CO(g)的燃烧热是283.0KJ/mol,则表示CO(g)燃烧反应的热化学方程式为: CO(g)+1/2 O2(g)= CO2(g);△H=-283.0KJ/mol |
| B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3KJ/mol,则表示稀硫酸与稀氢氧化钡 溶液发生反应的热化学方程式为:H+ (aq) + OH-(aq) = H2O(l);△H=-57.3KJ/mol |
| C.铝热反应是放热反应,但需要足够的热量才能使反应发生 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、PH减小 |
在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g)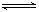 pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
pC(g)+qQ(g) 当m、n、p、q为任意整数时,达到平衡的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D) =m:n:p:q
⑥单位时间内m mol A断键反应,同时pmol C也断键反应
A.③④⑤⑥B.②③④⑥C.①③④⑤ D. ①③④⑥
下列实验操作能达到目的的是
| A.除去苯中混有的少量苯酚:加入适量NaOH溶液,振荡、静置后分液 |
| B.除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液 |
| C.检验卤代烃中的卤原子:取少量液体与NaOH溶液共热后滴加AgNO3溶液 |
| D.检验FeCl3溶液中是否含有Fe2+:取少量溶液先滴加氯水,再滴加KSCN溶液 |
下列有关物质的性质和应用正确的是
| A.油脂在酸性条件下水解生成高级脂肪酸和甘油 |
| B.福尔马林可防腐,可用它保存海鲜产品 |
| C.乙醇、糖类和蛋白质都是人体必需的营养物质 |
| D.合成橡胶与光导纤维都属于有机高分子材料 |
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应:Fe2O3+ 3Na2O2 2Na2FeO4 + Na2O,下列说法正确的是
2Na2FeO4 + Na2O,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| C.3 mol Na2O2发生反应,有12 mol电子转移 |
| D.Na2FeO4既是氧化产物又是还原产物 |
下列现象或应用不能用胶体的知识解释的是
| A.可吸入颗粒(如硅酸盐粉尘),吸入人体,对人体健康危害极大 |
| B.土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 |
| C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 |
| D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀 |