短周期元素W、X、Y、Z、在元素周期表中的位置如图所示,
| W |
|
|
|
|
|
|
|
| |
|
|
X |
Y |
Z |
|
|
其中X、Y、Z三种元素的质子数之和为21。
(1)W与Z形成原子个数比为1∶1的化合物,其电子式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈
酸性,其原因是 (用化学用语表示);
该溶液中各种离子浓度由大到小的顺序为 。
(3)由X W4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为
。
(4)已知:2YZ2(g) 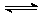 Y2Z4(g);△H<0。在恒温恒容条件下,将一定量XZ2和X2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间
Y2Z4(g);△H<0。在恒温恒容条件下,将一定量XZ2和X2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间
t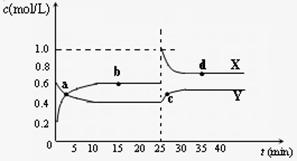 的变化关系如右图所示。
的变化关系如右图所示。
① a、b、c、d四个点中,化学反应
处于平衡状态的是 点。
② 25 min时,增加了
(填物质的化学式) mol。
③ a、b、c、d四个点中所表示的反应体系
中,气体颜色由深到浅的顺序是 __
(填字母)。
有X、Y两种元素,Y的第三个电子层上有2个电子,X的最外层电子数是其电子层数的3倍,请写出其原子结构示意图:X、;Y、。
填写下列表格
| 微粒符号 |
核电荷数 |
中子数 |
核外电子数 |
质量数 |
| 11 |
12 |
11 |
||
| 16 |
18 |
32 |
(1)1molO2与1molO3分子数之比为,原子数之比为
(2)含有O原子物质的量相同的SO2与SO3,分子数之比为,所含的S原子数之比为,所含的原子总数之比为
从四大基本反应类型看,反应都属于氧化还原反应,反应和
反应部分属于氧化还原反应,反应全部都属于非氧化还原反应。
向NaOH溶液中通入CO2气体,充分反应后,在所得溶液中逐滴加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示。
试填写下列空白:
V(CO2)/L
(1)与盐酸反应前,A溶液中的溶质是。
(2)其物质的量之比是。