下图所示对实验仪器名称的标注或实验操作正确的是 ( )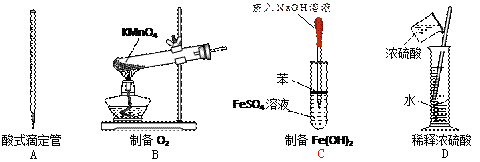
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36,常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为 1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是
| 编号 |
HX |
YOH |
溶液的体积关系 |
| ① |
强酸 |
强碱 |
V(HX)=V(YOH) |
| ② |
强酸 |
强碱 |
V(HX)<V(YOH) |
| ③[ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
| ④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A.①③B.②③ C.①④D.②④
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
| A.溶液中由水电离产生的H+浓度为1×10-7 mol/L |
| B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L |
| C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度 |
| D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列各选项中所述的两个量,前者一定大于后者的是
| A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积 |
有关常温下pH均为3的醋酸和硫酸的说法正确的是
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同[ |