下列离子方程式正确的是
| A.向NaAlO2溶液中通入过量CO2:AlO2—+CO2+2H2O= Al(OH)3↓+CO32— |
| B.用氯化铁溶液腐蚀铜板:2Fe3++Cu=Cu2++2Fe2+ |
| C.用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O |
| D.Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3—=9Fe3++NO↑+14H2O |
用下列实验装置进行相应实验,能达到实验目的的是
| A.用图1所示装置验证浓硫酸具有强氧化性 |
| B.用图2所示装置制取干燥的NH3 |
| C.用图3所示装置制取并收集乙烯 |
| D.用图4所示装置制取Cl2 |
下列有关物质性质与应用对应关系错误的是
| A.常温下,浓硫酸能使铝钝化,可用铝制容器贮运浓硫酸 |
| B.二氧化硅熔点很高、硬度很大,可用于制造坩埚 |
| C.氯化铁溶液能腐蚀铜,可用于制作印刷电路板 |
| D.金属钠硬度小、密度小,可用于制造高压钠灯 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+ |
| B.0.1 mol·L-1 FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
| C.滴入甲基橙显黄色的溶液中: Na+、ClO-、I-、SO42- |
| D.水电离产生的c(H+)=10-12 mol·L-1的溶液中:K+、Na+、NO3-、CH3COO- |
下列有关化学用语表示正确的是
| A.HClO的结构式:H—Cl—O |
B.羟基的电子式: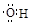 |
| C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- |
| D.异丙醇的结构简式:CH3CH2CH2OH[来 |
下列说法错误的是
| A.使用可降解塑料聚二氧化碳,能减少白色污染 |
| B.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 |
| C.雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
| D.通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 |