(共15分) 请根据下图作答:
已知:一个碳原子上连有两个羟基时,易发生下列转化:
(1)反应①所属的有机反应类型是_______________反应。
(2)反应③的化学方程式______________________________________________________。
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2)∶n (H2O) = 2∶1,则B的分子式为 。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G的结构有 种。
(6)化合物H是B的同分异构体,H分子中含有的部分结构为 ,它的水解产物经聚合反应后可得到高聚物(CaHbO2)n.。H有多种结构,写出其中一种的结构简式 。
,它的水解产物经聚合反应后可得到高聚物(CaHbO2)n.。H有多种结构,写出其中一种的结构简式 。
莽草酸是合成治疗禽流感的药物—达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下: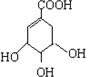 (提示:环丁烷
(提示:环丁烷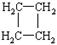 可简写成
可简写成 )
)
(1)A的分子式是
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是:
(3)A与氢氧化钠反应的化学方程式(有机物用结构简式表示)是:
(4)17.4g A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积(标准状况)L。
有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:ABCD。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质;B与E形成的化合物;
A、B、E形成的化合物;D、E形成的化合物。
如图所示装置
(1)若烧杯中溶液为稀硫酸,则观察到的现象为。两极反应式为:正极;负极。
该装置将能转化为能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为,
总反应方程为。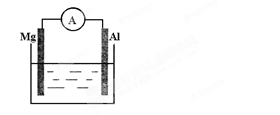
指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭,
(2)给手机的电池充电,
(3)用畜电池点亮灯泡,
(4)电解水得到O2和H2。
在原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)气态氢化物水溶液呈碱性的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的元素是_____________。