在T1℃时,向容积为2 L 的密闭容器甲中加人1mol N1、3mol H2及少量固体催 化剂,发生反应N2(g) + 3H2(g)  2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
(1) 该反应在0 ~l0min 时间内H2的平均反应速率为______,N2的转化率为______。 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
a.大于25% b.等于25% c.小于25%
(3)右图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T1>T2)时H2的体积分数随时间t的变化曲线。
(4)若保持T1℃,在体积也为2 L 的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入H2的物质的量x的取值范围是____________。
如图甲所示,某同学将一小块钠放在石棉网上加热,观察到生成的产物除了淡黄色固体外还有一些黑色固体物质,当时他想这种黑色物质应该是钠表面吸附的煤油不完全燃烧产生的碳单质,但在学习了镁与C02的反应后,该同学想:就金属活动性而言,Na比Mg还强,该黑色物质是否是Na与C02反应生成的碳单质。为了验证自己的想法,该同学利用装置乙进行实验。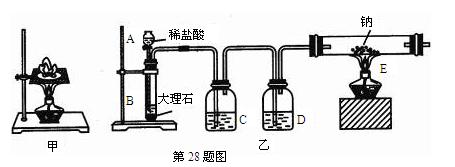
实验步骤如下:①切取一小块金属钠,用滤纸完全吸干煤油,再除去表面的氧化层,放进干燥的E中;
②打开分液漏斗的活塞,使B中的反应进行一段时间后,再点燃E处的酒精灯。
实验现象如下:钠在充满C02气体的玻璃管中剧烈燃烧起来,产生大量的白烟;玻璃管中有黑色物质生成;待玻璃管冷却后,管壁上附着一层白色物质。
请回答下列问题:
(1)C中盛放的试剂是,作用是。D中盛放的试剂是,作用是。
(2)B中的反应进行一段时间后,再点燃E处的酒精灯的目的是。
(3)该同学将白色物质和黑色物质分别溶于水,发现黑色物质不溶于水,白色物质能溶于水。由此,该同学得出结论,该黑色物质是Na与C02反应生成的碳单质,则其他生成物还应该有。
(4)请设计一实验方案验证玻璃管内Na与C02反应生成的白色物质的成分,并写出实验步骤、现象和结论。
(5)若先点燃E处的酒精灯,再打开分液漏斗的活塞,写出此时玻璃管E中可能发生的反应的化学方程式。
甲、乙、丙、丁、戊均为中学化学中常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如图所示。
(1)若R为一种非金属元素,且上述五种物质含右不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下戊相对H2的密度为14。
写出由甲生成戊的化学方程式,欲检验乙中官能团,所选用的试剂为(填序号)。
①NaOH溶液 ②Br2的CCl4溶液 ③银氨溶液 ④AgNO3溶液 ⑤稀HNO3
(2)若R为另一种非金属元素;甲与丙为常见大气污染物,且甲与丙的相对分子质量之差为1 6。丁为空气的主要成分之一。则丁的电子式为,乙的空间构型为。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为。
6。丁为空气的主要成分之一。则丁的电子式为,乙的空间构型为。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为。
(3)若R为一种金属元素,甲溶液的pH小于7,乙由两种元素组成,单质丁在二定条件下可生成戊。甲与戊两种溶液混合能生成沉淀丙,其离子方程式为,若镁粉中混有少量的丁,除去丁的离子方程式为。
(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
(1)此时A的浓度c(A)=________mol/L,x的值为________;
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(3)平衡时n(A): n(B): n (C): n(D) =
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X元素所处的周期数、主族序数、原子序数均相等;Y的原子半径是其所在主族中最 小的,而
小的,而 Z原子的最外层电子数是其电子层数的三倍,Y和Z可以形成两种以上气态化合物,则
Z原子的最外层电子数是其电子层数的三倍,Y和Z可以形成两种以上气态化合物,则
(1) Y在周期表中的位置是第 ___周期第________族;
___周期第________族;
(2)由Y和Z组成,且Y和Z的质量比为7:8的化合物的化学式(或分子式)是 。
。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是____和。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4︰2︰3,该盐的化学式(分子式)是。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
 ⅢA ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号或化学式,下同)。
(2)在这些元素中,其最高 价氧化物的水化物中,酸性最强的化合物的分子式是,碱性最强的化合物的化学式是。
价氧化物的水化物中,酸性最强的化合物的分子式是,碱性最强的化合物的化学式是。
(3)最高价氧化物是两性氧化物的元素是;写出它最高价氧化物对应水化物与氢氧化钠反应的离子方程式。
(4)用电子式表示元素④与⑥形成化合物的形成过程:,
(5)表示③与①最高价态形成的化合物电子式,该化合物分子是
由(填“极性”“非极性”)键形成。