下列离子方程式不正确的是:
| A.向偏铝酸钠溶液中加入少量的NaHSO4溶液 AlO2- + H+ + H2O = Al(OH)3↓ | |
B.在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解: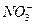 3BaSO3+ 2H+ + 2= 3BaSO4↓ + 2NO↑ + H2O 3BaSO3+ 2H+ + 2= 3BaSO4↓ + 2NO↑ + H2O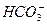 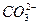 |
C.碳酸钠溶液中通入少量HCl:+ H+ = |
| D.氧化铁可溶于氢碘酸:Fe2O3+ 6H+ = 2Fe3+ + 3H2O |
下列热化学方程式中 ΔH的数值能表示可燃烧热的是
| A.H2(g) + Cl2(g) =" 2HCl(g)" ΔH =-184.6kJ/mol |
| B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g)ΔH =-802.3kJ/mol |
| C.2H2(g) + O2(g) = 2H2O(l)ΔH =-571.6kJ/mol |
| D.CO(g) + 1/2O2(g) = CO2(g)ΔH =-283kJ/mol |
下列反应中,既是氧化还原反应,又是△H>0的反应的是
| A.铝粉和三氧化二铁反应 | B.Ba(OH)2·8H2O和NH4Cl晶体混合反应 |
| C.灼热的焦炭与二氧化碳反应 | D.镁和稀硫酸反应 |
将pH=2的盐酸和pH=2的醋酸溶液分别用蒸馏水稀释相等的倍数,稀释之后
两溶液的pH大小
| A.前者大 | B.后者大 | C.相等 | D.无法确定 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加大的是
| A.加热 | B.不用稀硫酸,改用98%的浓硫酸 |
| C.滴加少量CuSO4溶液 | D.不用铁片,改用铁粉 |
下列说法中错误的是
| A.凡是放热反应而且熵增加的反应,就更易自发进行; |
| B.对于同一物质在不同状态时的熵值是:气态>液态>固态; |
| C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率也越大; |
| D.凡是能量达到活化能的分子发生的碰撞均为有效碰撞。 |