下列离子方程式正确的是 ( )
| A.向滴有酚酞的硅酸钠溶液中滴加盐酸至浅红色: 2H++SiO2-4=H2SiO3(胶体) |
| B.酸性条件下KIO3溶液与KI溶液发生反应生成I2: IO-3+5I-+3H2O=3I2+6OH- |
| C.SO2气体使酸性KMnO4溶液褪色: SO2+4H++MnO-4=SO2-4+Mn2++2H2O |
| D.银氨溶液与乙醛发生银镜反应: |
CH2CHO+2Ag(NH3)+2+2OH- CH3COO-+NH+4+3NH3+2Ag↓+H2O
CH3COO-+NH+4+3NH3+2Ag↓+H2O
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol/L |
| B.V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)=1×10-7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)>c(HC2O4-)>c(C2O42-) |
室温下,向a mol/L氨水中逐滴加入盐酸,下列描述不正确的是
| A.pH减小 | B.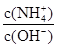 增大 增大 |
| C.水的电离程度先减小后增大 | D.Kb(NH3·H2O)不变 |
下列实验不能达到目的的是
| A.向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 |
| B.只用少量水就可鉴别Na2CO3和NaHCO3固体 |
| C.用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 |
| D.用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是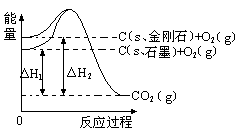
| A.石墨和金刚石的转化是物理变化 |
| B.C(s、石墨)==C(s、金刚石) △H=" +1.9" kJ•mol-1 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
化学反应的发生一般可通过现象加以判断。根据下列现象判断,其中没有新物质生成的是
①蛋白质溶液中加入硫酸铵后形成沉淀
②向氢氧化铁胶体中滴加盐酸产生沉淀;
③二氧化氮经加压冷凝成无色液体;
④溴水滴入裂化汽油中振荡褪色;
⑤硫酸铜粉末滴加少量水变蓝;
⑥活性炭除去水中的颜色和异味
| A.①②③ | B.②④⑥ | C.④⑤⑥ | D.①②⑥ |