下图所示各装置的叙述中,正确的是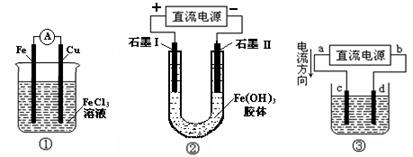
| A.装置①是原电池,总反应是:Cu + 2Fe3+ = Cu2+ + 2Fe2+ |
| B.装置①中,铁做负极,电极反应式为:Fe3+ + e- = Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是( )
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质化合生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
根据电子排布的特点,Cu在周期表属于( )
| A.s区 | B.p区 | C.d区 | D.ds区 |
下列说法中正确的是( )
| A.共价键的键能越大,分子晶体的熔点越高 |
| B.失去电子难的原子获得电子的能力一定强 |
| C.在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
| D.电子层结构相同的不同简单离子,其半径随核电荷数增多而减小 |
下列说法不正确的是( )
| A.离子晶体的晶格能越大,离子键越强 |
| B.阳离子的半径越大则可同时吸引的阴离子越多 |
| C.通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成的离子化合物的晶格能越大 |
| D.拆开1mol离子键所需的能量叫该离子晶体的晶格能 |
聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是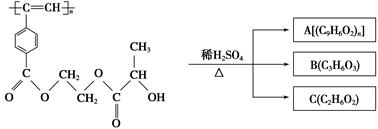
A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C.1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D.A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2