(10分)原子序数依次增大的五种短周期元素X、Y、Z、Q、R,已知X与Q同主族,Y、Z原子序数之比为3:4,Z的最外层电子数是Q的最外层电子数的6倍,R为同周期中原子半径最小的元素(稀有气体元素除外),X与R形成的化合物常温下为气态。
(1)表示Y元素中质子数与中子数相等的同位素符号是 。
(2)Q与Z形成的原子个数比为1:1的化合物的电子式是 。
(3)A+B→C+D+H2O为中学化学中常见的反应形式,A、B、C、D均为由上述五种元素组成的单质或化合物。
①如A为NaOH、B为CO2时,可写成aNaOH + bCO2 = cNa2CO3 + d NaHCO3 + nH2O,a与b的物质的量之比应满足的关系是 。现向l00 mL、3 mol/L的NaOH溶液中缓慢通入标准状况下4.48 L的CO2气体,用l个化学方程式表示以上反应
(化学计量数为最简整数),此时溶液中各种离子物质的量浓度由高到低的排列顺序是_ _。
②请任写一个符合A+B→C+D+H2O形式的氧化还原反应方程式,其中C、D均为盐
。
发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g)⊿ H1= + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g)⊿ H2 = - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O(g)⊿ H3= - 484kJ/mol;
H2(g)+F2(g)=2HF(g)⊿ H4= - 538kJ/mol
写出N2H4与 NO2反应的热化学方程式________________________________________,
写出N2H4与F2反应的热化学方程式__________________________________________。
已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ) ,反应过程中能量变化如下图: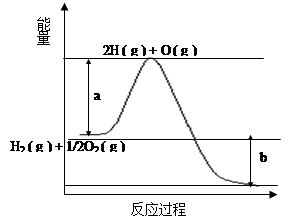
请回答下列问题:
(1)图中a,b分别代表什么意义?
a.;b.。
(2)该反应是反应(填“吸热”或“放热”),△H(填“< 0”或“> 0”)。
下图是一个电化学过程的示意图。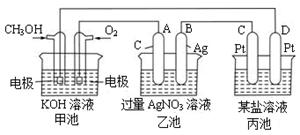
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为
(4)当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
| A.MgSO4溶液 | B.CuSO4溶液 | C.NaCl溶液 | D.AgNO3溶液 |
(12分)环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
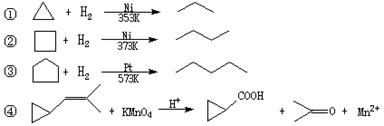
回答下列问题:
(1)写出与环丙烷不同类别但互为同分异构体的有机物的结构简式________________。
(2)反应①~③的反应类型是_______,其中最容易发生此类反应的环烷烃是(填名称)。
(3)环烷烃还可以与卤素单质、卤化氢发生类似①~③的反应,如环丙烷与Br2可在一定条件下发生反应,反应得到的产物键线式____________,该物质还有_______种同分异构体。
(4)要鉴别环己烷和己烯,方法是;
(一)写出下列有机物的系统命名或结构简式:
(1)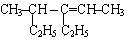 _____________________________
_____________________________
(2)CH3CH(CH3)C(CH3)2(CH2)2CH3
(3) 2-甲基-2-戊烯 _____________________________________
(二).下面列出了几组物质,请将物质的合适组号填写在下表中。
① 和
和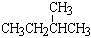 ; ②
; ② 和
和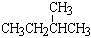 ;
;
③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦35Cl2和37Cl2
⑧乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑨氧气(O2)与臭氧(O3)⑩ H2O与D2O
| 类别 |
同位素 |
同系物 |
同素异形体 |
同分异构体 |
| 组号 |