已知:2CO(g)+O2(g)=2CO2(g) ΔH=" —566" kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2 O2(g) ΔH=" —226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是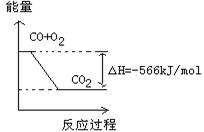
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>—452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
| A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl- |
| B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- |
| C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO |
| D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是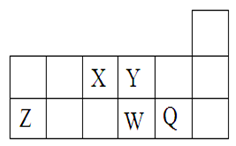
| A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+) |
| B.元素W的最高价氧化物对应水化物的酸性比Q的强 |
| C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应 |
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
② NH3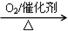 NO
NO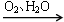 HNO3
HNO3
③NaCl(饱和)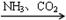 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3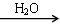 H2SO4
H2SO4
| A.②③ | B.①④ | C.②④ | D.③④ |
某实验过程如图所示,则图③试管中的现象是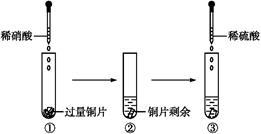
| A.铜片溶解,产生无色气体,该气体遇空气变为红棕色 |
| B.铜片溶解,产生无色气体,该气体遇到空气不变色 |
| C.铜片溶解,放出红棕色有刺激性气味的气体 |
| D.无明显现象,因稀硫酸不与铜反应 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.1mol甲基(-CH3)含有9NA个电子 |
| B.标准状况下,22.4LSO3含有的原子数为4NA |
| C.0.10mol.L-1NaOH溶液中含有OH-离子数是0.1NA |
| D.5.6g Fe与2.24LCl2充分反应转移电子数为0.2NA |