现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答: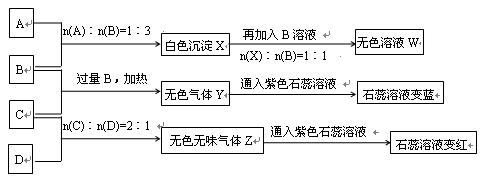
(1)X与B反应的离子方程式为 。
(2)D溶液pH值大于7,原因是(用离子方程式表示) 。
(3)写出C与过量B反应(加热)的离子方程式 __________________ 。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序_____________________.
(5)Y在同主族的同类物质中分子稳定性最强( ),也是沸点最高的( )。(判断正误填"是"或"否")
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1 ,△H2,△H3 ,则三者由大到小排序为:___________________.
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题: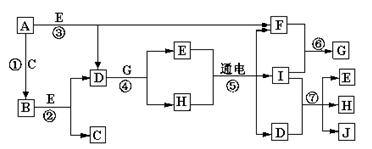
(1)B中的化学键有,(填“离子键”、“极性键”或“非极性键”)E的电子式。
(2)写出反应⑦的离子方程式 _______ ___________________。
___________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)极附近溶液由无色变为红色,其原因是。
毒品冰毒属于芳香族化合物,分子中只含有碳、氢、氮三种元素,相对分子质量不超过150,碳元素和氢元素质量分数之和为90.6%。请按要求填空:
(1)冰毒的摩尔质量为,分子式为。
(2)冰毒的同分异构体有很多,写出同时符合下列三项要求的冰毒的同分异构体的结构简式。(只要求写出其中的三种)
①苯环上只含有两个相邻的取代基
②分子中含有氨基(—NH2)
③分子中含有两个甲基(—CH3)
、、
有机化合物A为一元溴代有机酸,仅含C、H、O、Br元素,与A相关的反应框图如下:
⑴写出下列反应过程中的有机反应类型:
A→C中①是 ,C→E是 。
⑵写出F的结构简式: 。
⑶写出与C具有相同官能团的同分异构体的结构简式 。
⑷写出反应A→B的化学方程式:
(1)根据系统命名法(IUPAC)命名或书写下列有机物的结构简式
①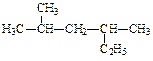
②2—甲基—1—丁烯
(2)请写出下列反应的化学方程式:
①向苯酚钠溶液中通入二氧化碳:______________________
②丙醛和新制的银氨溶液反应:_________________________________
③实验室制乙烯:
④制取TNT:
⑤硬脂酸甘油酯发生皂化反应:
乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是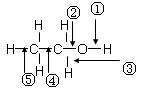
⑴和金属 钠作用时,断裂键______
钠作用时,断裂键______
⑵和浓硫酸共热至170 ℃时,断裂键______
⑶ 和乙酸、浓硫酸共热时,断裂键_______
和乙酸、浓硫酸共热时,断裂键_______
⑷在铜催化下和氧气反应时,断裂键_____
⑸与氢卤酸反应时,断裂键______