少量铁粉与100ml 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体
⑤加NaCl溶液 ⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
⑧改用10ml 0.1mol/L的盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.③⑥⑦⑧ |
将标准状况下的a L 氯化氢气体溶于1L 水中,得到的盐酸的密度为b g/mL,则该盐酸的物质的量的浓度是
A.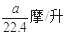 |
B. |
C. |
D. |
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2 + O2 → 2CH3CHO。 下列有关说法正确的是
| A.该电池为可充电电池 |
| B.每有0.1mol O2反应,则迁移H+ 0.4mol |
| C.正极反应式为:CH2=CH2-2e- + 2OH- = CH3CHO +H2O |
| D.电子移动方向:电极a→磷酸溶液→电极b |
下列表示对应化学反应的离子方程式正确的是
| A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O |
B.5molFe和4molCl2反应:5Cl2+4Fe  2FeCl2+2FeCl3 2FeCl2+2FeCl3 |
| C.向Ca(ClO)2溶液中通入过量的 SO2:C1O- + SO2 + H2O =" HClO" + HSO3- |
| D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2 = 2Fe3++2OH- |
已知X、Y、Z、W为短周期主族元素,在周期表中相对位置如图所示,下列说法正确的是
A.若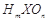 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数) 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数) |
| B.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸 |
| C.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱 |
| D.若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应 |
以下数值大于或等于阿伏加德罗常数的是
| A.含4.8g碳元素的石墨晶体中的共价键数 |
| B.250 mL 1 mol·L-1FeCl3溶液中,阴、阳离子总数 |
| C.一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数 |
| D.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成0.5 molCl2转移的电子数 |