如图
|
甲把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片上的描述合理的是( )
 卡片号:2009.3
卡片号:2009.3
 实验后的记录:
实验后的记录:
①Cu为阳极,Zn为阴极
②Cu极上有气泡产生
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
 ⑤电子流向是:Cu Zn
⑤电子流向是:Cu Zn
⑥正极反应式:Cu + 2e- = Cu2+
图甲 图乙
| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
下列叙述错误的是()
| A.乙酸与乙醇发生酯化反应时,乙酸分子中羟基上的氢原子跟乙醇分子中的羟基结合生成水 |
| B.乙酸可用来除去热水瓶中的水垢(主要成分为碳酸钙) |
| C.乙酸与乙醇发生酯化反应时,浓硫酸的作用是既起催化作用又起吸水作用 |
| D.常温下乙酸是具有强烈刺激性气味的无色液体 |
已知短周期元素的离子,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是()
| A.原子半径 A>B>D>C | B.原子序数d>c>b>a |
| C.离子半径 C>D>B>A | D.单质的还原性 A>B>D>C |
右图是制取和收集某气体的实验装置,该装置可用于()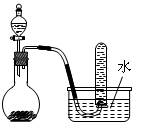
A.浓盐酸和二氧化锰反应制取Cl2 |
B.浓氨水和生石灰反应制取NH3 |
C.浓硝酸与铜反应制取NO2 |
| D.二氧化锰固体和双氧水反应制取O2 |
把镁条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是:()
| A.盐酸的浓度 | B.镁条的表面积 | C.溶液的温度 | D.加少量Na2SO4固体 |
现在电视上有一“自热米饭”的广告播的很火,它介绍在食用时,将一无色液体加入到一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,就可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合()
| A.硝酸铵和水 | B.浓硫酸和水 | C.氧化钙和水 | D.固体酒精和水 |