已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示: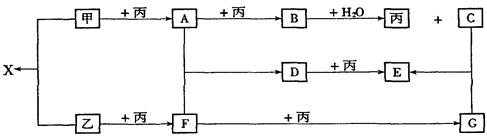
(1)写出X的电子式和G的化学式:X__________,G__________;
(2)写出有关变化的化学方程式:
B+H2O:______________________________;
D+丙:______________________________。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显价,A的电负性B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:。组成最简单氨基酸碳原子杂化类型是______________________。
(3)实验证明:KC1、MgO、CaO、TiN这4种晶体的结构与NaC1晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:则该4种离子晶体(不包括NaC1)熔点从高到低的顺序是:。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的是Mg2+有个。

(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。
(5)某配合物的分子结构如图所示,其分子,内不含有(填序号)。
| A.离子键 | B.极性键 |
| C.金属键 | D.配位键 |
E.氢键 F.非极性键
美国科学家理查德·海克和日本科学家根岸英一、伶木彰因在研发“有机合成中的钯催化的交叉偶联”而获得诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收,一种由废催化剂制取氯化钯的工艺流程如下:
(1)甲酸还原氧化钯的化学方程式为。
(2)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdC14,硝酸被还原为NO,该反应的化学方程式为:。
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1—图3所示,则王水溶液钯精渣的适宜条件(温度、时间和王水用量)为、、。
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2—。此时铁的存在形式是(写化学式)
(5)700℃焙烧1的目的是:;550℃焙烧2的目的是:。
I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是;实验室在配制FeSO4溶液时常加入以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是。
②计算上述产品中FeSO4·7H2O的质量分数为。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为(用离子方程式表示)
I.铝的阳极氧化能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸,模拟该生产过程如下:
(1)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜有关反应的离子方程式____________
(2)如图,组装好仪器,通电约25min。在阳极生成氧化铝,阴极产生气体。则该过程中阳极发生反应的电极式为______;该溶液pH的变化______(填:“增大”或“减小”或“不变”)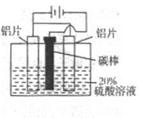
II现代社会对电池的需求越来越大,尤其足可充电的二次电池。
髙铁电池是一种新型可充电电池,总反应为:3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
氮及其化合物在工农业生产、生活中有者重要作用。请回答下列问题: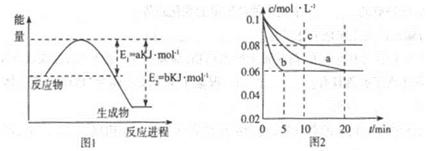
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能星变化示意图(a、b均大于0,)且知:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ·mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式____________;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1,c(H2)=0.3mol·L-1;合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①计算在a达平衡时H2的转化率为______;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是______;
试写出判断b与a条件不同的理由____________;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如下表:
①试确定K1的相对大小,K1______4.1x106(填写“>”“-”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是______(填序号字母)。
A.容器内NH3的浓度保持不变 B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)______。
②250C时,将pH=x氨水与pH=y的疏酸(且x+y=14,x>11)等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.[SO42-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[SO42-]>[OH-]>[H+]
C.[NH4+]+[H+]>[OH-]+[SO42-]
D.[NH4+]>[SO42-]>[H+]>[OH-]