常温下,某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 。下列判断正确的是 ( )
| A.该溶液可能由0.1 mol/L的CH3COOH与0.1 mol/L的NaOH溶液等体积混合而成 |
| B.该溶液可能由0.2 mol/L的CH3COOH与0.1 mol/L的NaOH溶液等体积混合而成 |
| C.该溶液可能由pH =3的CH3COOH与pH =11的NaOH溶液等体积混合而成 |
| D.在该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为: |
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
下列关于元素周期表的说法不正确的是
| A.元素周期表中一共有16个纵行 |
| B.除零族元素外,非金属元素全都是主族元素 |
| C.同周期ⅡA族与ⅢA族元素的原子序数之差可能为25 |
| D.同族上下相邻两种元素的原子序数之差可能为32 |
下列与化学键有关的说法中正确的是
| A.由活泼金属元素和活泼非金属元素形成的化合物不可能含共价键 |
| B.不同种元素的原子形成的共价键一定是极性共价键 |
| C.离子键是指阴、阳离子间的静电引力 |
| D.在气体单质分子里一定有共价键 |
下表各组物质中,满足如图所示一步转化关系的选项是
| 选项 |
X |
Y |
Z |
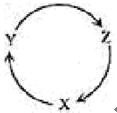 |
| A |
Na |
NaOH |
NaHCO3 |
|
| B |
Cu |
CuSO4 |
Cu(OH)2 |
|
| C |
C |
CO |
CO2 |
|
| D |
Si |
SiO2 |
H2SiO3 |
下列有关化学研究的正确说法是
| A.化学家提出的假设不一定能被实验证实 |
| B.同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
| C.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 |
| D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,标志着化学已成为以理论研究为主的学科,不需要再做化学实验 |
右图是温度和压强对反应X+Y 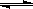 2Z的影响示意图,图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z的影响示意图,图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
| A.X和Y中只有一种为气态,Z为气态 |
| B.X和Y都不为气态,Z为气态 |
| C.X、Y、Z均为气态 |
| D.上述可逆反应的正反应为放热反应 |