MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O2 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 2CO ZnO+CO
2CO ZnO+CO Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:

试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
12分)已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)=
mol·L-1, C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时将该密闭容器体积扩大1倍,则反应速率的变化是;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变
b.气体的密度不随时间改变
c. c(A)不随时问改变
d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数值是。若
A(g)+B(g)的平衡常数值是。若
此时给反应体系升温,(其他条件不变)则该平衡常数将 _____________ 。(填增大或减小或不变)
常温下,ZnS的溶度积常数Ksp=1.20×10-23 ,H2S的电离常数K1=1.32×10-7K2=7.10×10-15回答下列问题:
(1)K1>>K2的原因是
(2)0.1 mol/LH2S溶液中氢离子的物质的量浓度是(填字母)
| A.等于0.1mol/L | B.等于0.2mol/L |
| C.小于0.1mol/L | D.在0.1~0.2mol/L之间 |
(3)0.1mol/LNa2S 溶液能使pH试纸变蓝,表明该现象的离子方程式是
(4)已知0.1mol/LNaHS溶液的pH约为9,则0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是。该溶液中的质子守恒关系式为
。
(5)向0.01mol/L的ZnCl2溶液中通入H2S(g)至饱和(c(H2S)按0.1mol/L计),为保证不产生ZnS沉淀,应控制c(H+)不低于mol/L(已知7.811/2 =2.8)
下图中A~I分别代表有关反应中的一种物质,其中A为酸式盐,请回答下列问题: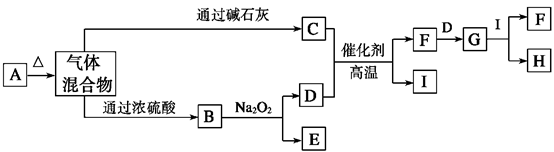 (1)A、F的化学式分别为、。
(1)A、F的化学式分别为、。
(2)I的电子式为;I的沸点较高的原因是
(3)E的水溶液中,各离子浓度由大到小的顺序为
。
(4)写出反应B+Na2O2→ D+E的化学方程式:
(5)指出实验室中保存H的方法及其原因:
已知:室温时,Ksp(AgCl)= 1.8×10-10mol2·L-2。请回答:
(1)饱和AgCl溶液的浓度是mol/L。
(2)将2.0×10-5mol·L-1的AgNO3溶液与2.0×10-5mol·L-1的NaCl溶液等体积混合则混合后C(Ag+)=,Qc=,因为QcKsp(填“>”或“<”),所以(填“有”或“无”)AgCl沉淀析出。
回答下列问题:
(1)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是,该实验说明的问题是。
(2)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是(填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是。