海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示),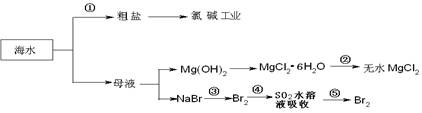
下列有关说法不正确的是
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是 ( )
| A.HA较强 | B.HB较强 | C.两者一样 | D.无法比较 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水,CH3COOH的电离程度变大,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列有关化学反应速率的说法中,正确的是 ( )
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
在一定温度下,向VL密闭容器中充入2molNO2,发生如下反应:2NO2(g)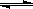 N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是()
N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是()
| A.α1=α3 | B.α1>α3 |
| C.α1<α3 | D.无法确定 |
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为: 2SO2(g)+O2(g) 2SO3(g);△H=-akJ·mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是()
2SO3(g);△H=-akJ·mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是()
| A.4 mo1SO2和2mol O2 | B.4mol SO2、2mo1 O2和2mol SO3 |
| C.4mol SO2.和4 mo1 O2 | D.6mo1 SO2和4 mo1 O2 |