银锌电池广泛用作各种电子仪器的电源,它的放电过程可以表示为Ag2O+ Zn+H2O = 2Ag+Zn(OH)2. 电池放电时,负极发生反应的物质是
| A.Ag | B.Zn | C.Ag2O | D.Zn(OH)2 |
日本地震导致核电站泄露出大量的人工放射性核素,如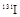 (碘)、
(碘)、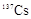 (铯)等。下列说法正确的是()
(铯)等。下列说法正确的是()
A.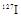 与 与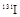 为不同的核素,但具有相同的化学性质 为不同的核素,但具有相同的化学性质 |
B.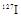 是碘元素稳定的同位素,与 是碘元素稳定的同位素,与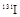 为互为同分异构体 为互为同分异构体 |
C.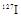 与 与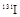 的质量数不同,核外电子排布方式也不同 的质量数不同,核外电子排布方式也不同 |
D.铯为IA元素,常温时,0.1mol·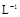 的 的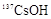 溶液,pH<13 溶液,pH<13 |
关于下列各装置图的叙述中,正确的是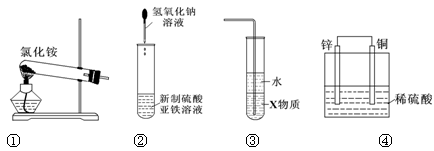
| A.实验室用装置①制取氨气 |
| B.装置②可用于制备氢氧化亚铁并观察其颜色 |
| C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| D.装置④是原电池,锌电极为负极,发生氧化反应 |
两种短元素X和Y的原子最外层电子数分别为1和7。下列说法正确的是
| A.元素X、Y的质子之和为12 |
| B.元素X和Y形成的可能是共价化合物 |
| C.元素X、Y分别位于周期表的ⅠA族和ⅦA族 |
D.用电子式表示X、Y原子形成化合物XY的过程如下: |
某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e- |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2 |
| D.放电过程中,溶液中K+向负极移动 |
有关0.1 mol/L的NH4Cl溶液的下列说法错误的是
| A.[H+]+[NH4+]=[Cl-]+[OH-] | B.[Cl-]>[NH4+]>[H+]>[OH-] |
| C.[H+]=[OH-]+[NH3﹒H2O] | D.加水稀释,NH4+的水解程度增大,酸性增强 |