下列过程中,共价键被破坏的是
| A.碘升华 | B.溴蒸气被木炭吸附 |
| C.加热NaCl使之融化 | D.碘化氢气体受热分解 |
下列关于杂化轨道的叙述中,不正确的是()
| A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| C.杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
下列四种元素中,其单质的氧化性最强的是()
| A.基态原子含有未成对电子最多的第二周期元素 |
| B.某激发态为1s22s12p3的原子 |
| C.基态原子最外层电子排布为2s22p6的元素 |
| D.基态原子最外层电子排布为3s23p5的元素 |
下列针对H3O+的说法中正确的是()
A中心原子上的孤电子对数为2
B O原子采用sp2杂化,空间构型为三角锥形
C离子中存在配位键
D纯水呈中性,纯水中不存在H3O+微粒
下列有关化学用语正确的是
A Na+的基态电子排布图是: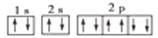
B质量数之和是质子数之和两倍的水分子符号可能是:
C Na2S的电子式: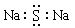
D氯离子结构示意图为: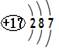
关于键长、键能和键角,下列说法不正确的是
| A.键角是描述分子立体结构的重要参数 |
| B.键长是形成共价键的两原子间的核间距 |
| C.键能越大,键长越长,共价化合物越稳定 |
| D.键角的大小与键长、键能的大小无关 |