下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法除去杂质。填表(全部填入序号,某序号可以填多次也可以不填):
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液。
C:(1)变性;(2)渗析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气;(7)盐析。
| 物质 |
加入试剂 |
操作方法 |
| ①苯(苯甲酸) |
|
|
| ②蛋白质(NaCl) |
|
|
| ③肥皂(甘油) |
|
|
| ④乙醇(水) |
|
|
| ⑤乙酸乙酯(乙酸) |
|
|
| ⑥乙烷(乙烯) |
|
|
⑴1mol H2SO4中含______mol个氧原子,个氢原子。
⑵4.5g水与________g硫酸所含的分子数相等,它们所含氧原子数之比是。
现有九种有机物:①乙烯 ②乙醇 ③乙醛 ④油酸 ⑤甲酸甲酯 ⑥葡萄糖 ⑦甘氨酸
(1)常温下能与溴水发生加成反应的是(填编号,下同)。
(2)能发生银镜反应的是。
(3)能发生酯化反应的是。
Fe3O4一种黑色粉末,又称磁性氧化铁,它的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
▲提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. ______________________________。
▲设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
⑴若假设1成立,则实验现象是______________________。
⑵若所得溶液显血红色,则假设_________成立。
⑶为进一步探究,继续向所得溶液加入足量铁粉,若产生______________的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
⑷为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若产生________________现象,则假设2成立;若产生_____________________现象,则假设3成立。
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。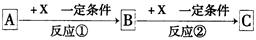 ,
,
试回答:⑴ 若X是强氧化性单质,则A不可能是_______________(可多选)。
A. S B. N2 C. Na D. Mg E. Al
⑵ 若A、B、C为含有同种金属元素的无机化合物,X为强电解质,A溶液与C溶液反应可生成B,则B的化学式可能为________,X的化学式可能为(写出不同类物质)________或_____________,反应①的离子方程式为___________________或_____________________。
⑶ 若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则A的电子式为______;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)____________,检验此C溶液中金属元素价态的操作方法是___________________。
(Ⅰ)将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒精灯上将该铜丝加热至红热状态。 如右图所示,趁热插入到试管里的氯化铵晶体中,在试管中出现白烟。冷却后取出铜丝,可看到铜丝变成光亮的紫红色。回答下列问题: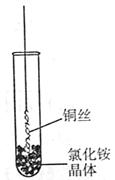
⑴解释“当红热的铜丝插入氯化铵晶体中,出现白烟”的原因(用化学方程式表示)。
⑵灼热的氧化铜在氯化铵中变成单质铜,写出该反应的化学方程式
。
( II)2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走。在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴N2H4·H2O能发生类似NH3·H2O的微弱电离,使溶液显示弱碱性,该电离分两步,写出第一步电离的方程式。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是(填序号字母)。
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.冷凝管 |
E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是。
⑶肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,每生成1molFe3O4,需要消耗肼的质量为g。