2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是
| A.甲醇 | B.甲烷 | C.丙烷 | D.乙烯 |
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
| A.HCO3- | B.Cl- | C.Mg2+ | D.Na+ |
自来水可以用氯气消毒、某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是 ①AgNO3 ②FeCl3 ③AlCl3 ④ NaOH ⑤FeCl2 ⑥Na2CO3
| A.①②⑥ | B.③④ | C.②③ | D.④⑤⑥ |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是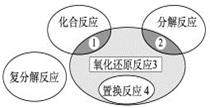
| A.Cl2+2KBr |
B.2NaHCO3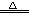 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O |
| D.2Na2O2+2CO2 |
归纳与推理是化学学习常用的方法。下列推理正确的是
| A.因为稀硫酸能与铁反应放出H2,所以浓硫酸与铁反应也一定能放出H2 |
| B.因为Na可以与水反应放出H2,所以K也可以与水反应放出H2 |
| C.因为CO2的水溶液可以导电,所以CO2是电解质 |
| D.因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性 |
下列有关化学用语和表述正确的是:
| A.元素铯的两种核素137Cs比133Cs多4个质子 |
B.S2-的结构示意图: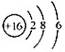 |
| C.质子数为53,中子数为78的碘原子:131 53I |
| D.决定核素种类的微粒数是质子数 |