某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如右图所示。则下列说法正确的是
| A.溶液中的阳离子只有H+、、Mg2+、Al3+ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| D.n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |
已知反应:①101kPa时,2C(s)+O2(g)═2CO(g);△H=﹣221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=﹣57.3kJ/mol.下列结论正确的是
| A.碳的燃烧热小于110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为﹣57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是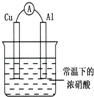
| A.Cu是原电池的负极 |
| B.Al是原电池的负极 |
| C.电子由Al沿导线流向铜 |
| D.铝片上的电极反应式为:Al﹣3e﹣═AL3+ |
在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g) + nB(g) ⇌pC(g) + qD(g) ,当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
| A.D的质量不再改变 |
| B.各组分的浓度不再改变 |
| C.反应速率υA:υB:υC:υD=m:n:p:q |
| D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
下列情况下,反应速率相同的是
| A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 |
| B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应 |
| C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 |
| D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
如图曲线a表示放热反应 X(g)+Y(g)⇌Z(g)+M(g)+N(s)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |