a、b的活动性均比氢强,a还可以从b的硝酸盐中置换出b。将a、b用导线相连放入CuSO4溶液中,下列叙述中不正确的是 ( )
| A.导线上有电流,电流方向由a到b | B.a极质量减少,b极质量增加 |
| C.b棒上析出氢气 | D.a棒发生氧化反应,b棒发生还原反应 |
键能是指断开1mol共价键吸收的能量或形成1mol共价键放出的能量,已知H-H键能为436kJ/mol,H-Cl键能为431kJ/mol, H2(g)+
H2(g)+ Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
| A.(2a-426)kJ/mol | B.(426-a)kJ/mol |
| C.(426-2a)kJ/mol | D.(426+a)kJ/mol |
恒温条件下,对于可逆反应A(g)+B(g) C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是
C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是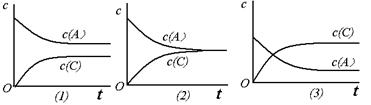
| A.(1)的K<1 | B.(2)的K≈1 | C.(3)的K>1 | D.以上三种可能全对 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为
2CH3OH + 3O2 + 4OH-  2CO32- + 6H2O, 则下列说法中正确的是
2CO32- + 6H2O, 则下列说法中正确的是
| A.充电时有CH3OH生成的电极为阳极 |
| B.充电时每生成1 mol CH3OH转移12mol电子 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32-+ 6H2O |
下列对实验现象的描述中错误的是
| A.向FeCl3和KSCN混合溶液中加入少量KCl固体,溶液血红色变浅 |
| B.向5mL 0.1mol/L K2Cr2O7溶液中加入少量NaOH固体,溶液由橙色变为黄色 |
| C.等体积等浓度Na2S2O3和H2SO4混合,温度升高出现浑浊和生成气体速度加快 |
| D.酸性KMnO4溶液中滴加H2C2O4,H2C2O4浓度越大褪色和生成气体速度越快 |
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是
| A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了 |
| B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 |
| C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大 |
| D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka ·Kh |