设NA为阿伏加德罗常数,下列叙述正确的是( )
①7Li+中含有的中子数与电子数之比为2:1
②Cl2的摩尔质量与NA个Cl2分子的质量在数值和单位上都相等
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④活泼金属从盐酸中置换出1molH2,转移电子数为NA
⑤在C2H6分子中极性共价键与非极性共价键数之比为3:1
⑥500mL0.5mol·L-1Al2(SO4)3溶液中,含SO42-数目为0.75NA
⑦5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
⑧常温常压下,0.5 NA个一氧化碳分子所占体积是11.2L
| A.①②⑤ | B.②③⑧ | C.①③⑥ | D.③④⑦ |
下列实验或操作正确的是
下列说法正确的是
A.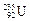 原子中,核内中子数与核外电子数的差值为143 原子中,核内中子数与核外电子数的差值为143 |
B.纯碱、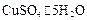 和生石灰分别属于盐、混合物和氧化物 和生石灰分别属于盐、混合物和氧化物 |
| C.凡是能电离出离子的化合物都是离子化合物 |
D.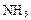 、硫酸钡和水分别属于非电解质、强电解质和弱电解质 、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
把一块镁铝合金投入到1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如右图所示。下列说法中错误的是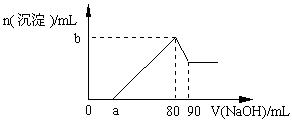
| A.盐酸的体积为80 mL |
| B.a的取值范围为0 < a<50 |
| C.n (Mg2+) < 0.025 mol |
| D.当a值为30时,b值为0.01 |
在25℃时,将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合,下列有关所得溶液的说法中错误的是
| A.溶液一定呈酸性 |
| B.向反应后的溶液中加入几滴稀盐酸,溶液的pH变化不大 |
| C.溶液中可能存在:c (H+) =c (CH3COO-)+c (OH-) |
| D.设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:Ka·Kh=Kw |
下列说法正确的是
| A.短周期元素X、Y的原子序数相差2,则X、Y不可能处于同一主族 |
| B.可根据氢化物的稳定性和酸性强弱,来判断非金属元素得电子能力强弱 |
| C.非金属元素的最高化合价不超过其元素原子的最外层电子数 |
| D.单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |