(1)研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,
其中合理的是 (填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解 |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象。
实验装置 实验现象 
(19分)黄铜矿的主要成分是CuFeS2(硫元素显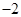 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下: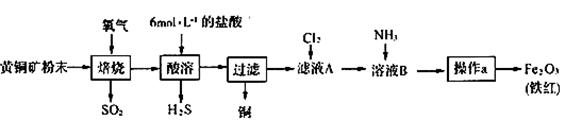
已知: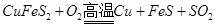
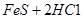 =
=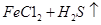
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。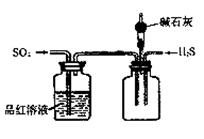
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。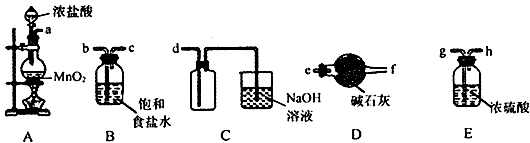
①圆底烧瓶中发生反应的离子方程式为________________________________________。
②按气流方向由左到右,导管口连接顺序为a→_________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是_________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是______(假设各步反应均完全进行且过程中无额外物质损耗)。
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为_________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
【化学与技术】将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要______________等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为_____________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是_____________________________。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_______。
a.熔点较低(29℃熔化) b.能导电
c.能制冷d.无毒
(6)上述工艺流程中体现绿色化学理念的是 。
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下: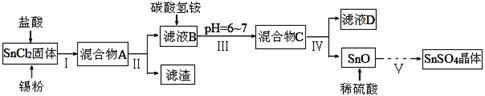
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有 ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为 。
③步骤Ⅴ涉及到的操作有:a.过滤 b.洗涤 c.蒸发浓缩 d.冷却结晶 e.低温干燥,则其正确的操作顺序为 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭_____(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
【改编】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下: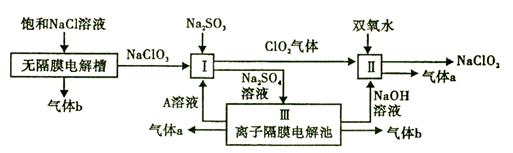
(1)气体b的化学式是 ,若装置III中生成49gA,则生成A的电极反应共 (填“失去”或“得到”)电子物质的量为 。
(2)I中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,
还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是 。