高铁酸钾(K2FeO4)是一种集氧化、吸附、
絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新
型、高效、绿色环保的多功能水处理剂。近十几年
来,我国对高铁酸钾在饮用水处理中的应用的研究
也不断深入,已取得可喜成果。比较理想的制备方
法是次氯酸盐氧化法:先向KOH溶液中通入足量
Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,
得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH)3;② 。
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4) =1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为 ,该反应的△H 0(填“>”“<”或“=”)。
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
 |
3Zn+2K2FeO4+8H2O 3Zn(OH)3+2Fe(OH)3+4KOH
该电池放电时的负极反应式为 ,若外电路有5.418×1022个电子通过,则正极有 g高铁酸钾参与反应。
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-2,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL。
①滴定时发生反应的离子方程式为 。
②原溶液中K2FeO4的浓度为 (用含字母的代数式表示)。
某芳香族化合物与苯酚无论以何种比例混合,只要总物质的量一定,完全燃烧时所消耗的氧气和生成水的质量始终一定。试回答:
(1)这类物质的相对分子质量与苯酚的相对分子质量之差为______的倍数(填数字)。
(2)现有这类物质中相对分子质量最小的物质A,已知A溶液能与NaHCO3反应放出气体。现取2.320g苯酚与A的混合物与50.00mLl.000mol/L的Na0H溶液充分反应后,加水至l00mL。取出其中的10.00mL用0.100 /L的
/L的 溶液滴定过量的NaOH,消耗20.00mL时至滴定终点。
溶液滴定过量的NaOH,消耗20.00mL时至滴定终点。
①该过程必须用的定量仪器除了电子天平外还有______、______。
②求该混合物中苯酚的质量分数(结果保留三位有效数字)。
有机物A是一种广谱高效食品防腐剂,图甲是A分子的球棍模型。回答问题: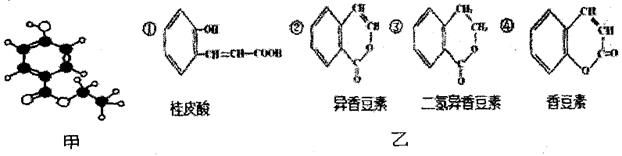
(1)写出A中含有官能团的名称_____________________、_____________________。
(2)A的一种同分异构体B在一定条件下可转化为二氢异香豆素,B的结构简式为____________________
(3)图乙中是一些中草药中所含的有机物:其中互为同分异构体的是(填写序号):____________;不能与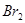 水反应的是(填写序号):______________;
水反应的是(填写序号):______________;
(4)A的另一种同分异构体C遇 溶液显紫色;l
溶液显紫色;l C可与l
C可与l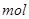 NaOH反应生成有机物D;D被
NaOH反应生成有机物D;D被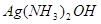 溶液氧化后经酸化得有机物E,E经醇化、消去两步反应可得香豆素,写出符合上述要求的一种C的结构简式:___________________________;
溶液氧化后经酸化得有机物E,E经醇化、消去两步反应可得香豆素,写出符合上述要求的一种C的结构简式:___________________________;
(5)写出A与烧碱溶液反应的化学方程式:______________________________________。
(A)下列有机实验操作或叙述,正确的是_______(填写代号)
①能使酸性高锰酸钾溶液褪色的烃,分子中一定含有碳碳双键或者碳碳三键
②乙酸乙酯中含有少量乙酸可用饱和的Na0H溶液除去
③蔗糖水溶解时应用弄 作催化剂
作催化剂
④在鸡蛋清溶液中滴入饱和的 溶液后有沉淀析出
溶液后有沉淀析出
⑤银镜反应的实质是Ag+把—CHO氧化成—COOH
⑥实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
(B)25℃~101kPa时,mg仅含三种元素的有机物在足量的 中充分燃烧。其燃烧产物通入过量的
中充分燃烧。其燃烧产物通入过量的 固体,固体质量增加了mg。
固体,固体质量增加了mg。
①下列物质中不能满足上述结果的是()
A.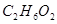 B.
B.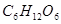 C.
C. D.
D.
②A是符合上述条件且相对分子质量最小的有机物,则A的电子式_______。
A中所有原子是否共面_______。(填‘是’或‘否’)
(C)用系统命名法命名下列物质 ①____________;
①____________;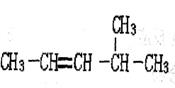 ②__________;
②__________;
(14分)研究表明:丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图1表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。写出230℃该反应的热化学方程式:_______________。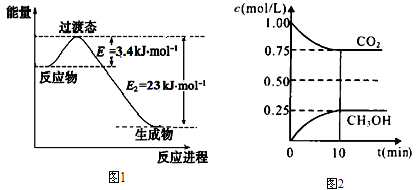
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①能说明该反应已经达到平衡状态的是_______________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=________。(保留两位有效数字)。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。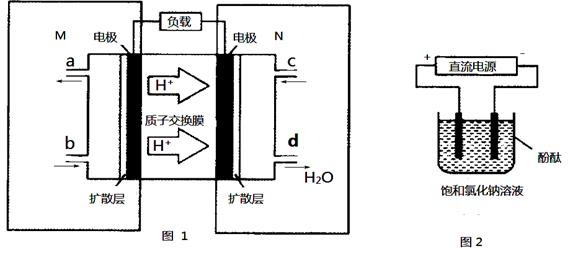
①M区发生反应的电极反应式为_________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:。假设溶液体积为300 mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为_______(忽略溶液体积变化)。
(12分)金属铜及其化合物在生产和生活中都有重要的应用。
(1)写出铜原子价电子层的电子排布式______________。第四周期基态原子最外层电子数与铜相同的元素有_____________种。
(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,然后向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4•H2O沉淀。
①SO42-中S原子的杂化方式为________________________。
②NH3分子内的H-N-H键角______(填“大于”“等于”或“小于”)H2O分子内的H-O-H键角。
(3)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为______________。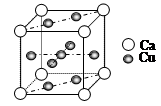
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构角度来说明CuO受热易分解的原因:__________________。