已知下列反应:
2FeCl3+2KI===2FeCl2+2KCl+I2
2FeCl2+Cl2===2FeCl3
I2+SO2+2H2O===H2SO4+2HI
判断下列物质的还原性由强到弱的顺序是
| A.I->Fe2+>Cl->SO2 | B.SO2>I->Fe2+>Cl- |
| C.Fe2+>I->Cl->SO2 | D.Cl->Fe2+>SO2>I- |
下列说法中正确的是
| A.用完的电池可以随意地丢弃 |
| B.增加炼铁高炉的高度可以降低尾气中CO的含量 |
| C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率 |
| D.把煤粉碎了再燃烧可以提高煤的燃烧效率 |
19世纪中叶,门捷列夫的突出贡献是
| A.提出原子学说 | B.发现元素周期律 |
| C.提出分子学说 | D.发现氧气 |
在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是()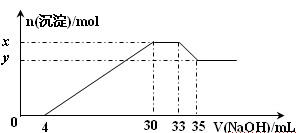
| A.x与y的差值为0.1 mol |
| B.原溶液中c(Cl-)=0.75 mol·L-1 |
| C.原溶液的pH=1 |
| D.原溶液中n(Mg2+)∶n(Al3+)=5∶2 |
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为()
| A.-Y kJ/mol | B.-(10X-Y) kJ/mol |
| C.-(5X-0.5Y) kJ/mol | D.+(10X-Y) kJ/mol |
锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,该电池的总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是()
| A.电解质溶液中混入水,对电池反应无影响 |
| B.上述过程中是电能转化成化学能 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1 |