A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,则X和B反应生成黑色固体Y 的化学方程式是 ,X在周期表中的位置是
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。(已知甲醇的燃烧热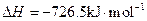 ,氢气的燃烧热
,氢气的燃烧热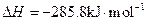 )
)
某蓄电池反应为NiO2+Fe+2H2O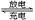 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是(填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用下图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示。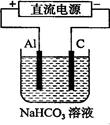
(4)精炼铜时,粗铜应与直流电源的极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
已知各离子沉淀时的情况如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀时的pH |
2.3 |
7.5 |
5.6 |
6.2 |
| 完全沉淀时的pH |
3.9 |
9.7 |
6.4 |
8.0 |
则加入H2O2的目的是,
发生反应的离子方程式为。乙同学认为应将方案中的pH调节到8,你认为此观点(填“正确”或“不正确”),理由是。
如图甲、乙是电化学实验装置。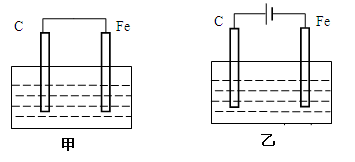
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中碳棒上的电极反应式为_________________;
②乙中碳棒上的电极反应式为;乙中总反应的离子方程式为__________;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为:______________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为__________________________________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_______(填写物质的化学式)________g(电解前后溶液的体积不变)。
将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。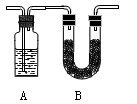
(1)A管应装入的物质,B管应装入的物质;
(2)此有机物的分子式;
(3)该有机物1分子中有1个苯环,试写出它的所有同分异构体的结构简式。
完成下列小题
I、某有机化合物结构简式如图所示: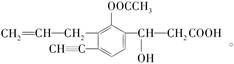
(1)写出其分子式________。
(2)写出所有含氧官能团的名称____________________。
(3)该有机化合物的性质与醋酸相似,写出该化合物与NaHCO3反应的方程式:
II、写出下列有机物的系统命名或结构简式:
(1) ____________。
____________。
(2)CH3CH(CH3)C(CH3)2(CH2)2CH3____________。
(3)间甲基苯乙炔____________。
(4)2-甲基-1,3-丁二烯____________。
下表为元素周期表的一部分用元素符号或化学式回答下列问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
① |
⑦ |
④ |
||||
| 3 |
③ |
⑤ |
⑧ |
⑩ |
||||
| 4 |
② |
⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________,该分子含有________(填“极性”或“非极性”)键。26号Fe元素在元素周期表中的位置是。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为。第三周期中除⑩元素以外离子半径最小的是(填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是(填化学式),元素⑦的氢化物的结构式为;该氢化物和元素④单质反应的化学方程式为。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为。在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为。
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式。
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式;该化合物与二氧化碳的方程式为;④⑧⑨元素的离子的还原性由强到弱顺序为(用离子符号答题)。