(12分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
① Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。该元素在周期表中的位置是 族。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 ;1 mol该晶体中含有 mol的化学键
(6分) A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
。
(3)将BA4,D2分别通入插在酸溶液中的两个电极形成燃料电池,则通BA4的一极的电极反应式为。
(4)化学反应3A2(g)+C2(g) 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图 表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为,平衡时压强为起始压强的倍。
表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为,平衡时压强为起始压强的倍。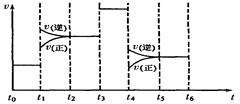
(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
①B中Sn极的电极反应式为__________________,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)__________。
②A中总反应离子方程式为__________。比较A、B、C中铁被腐蚀的速率,由快到慢 的顺序是________。
的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题: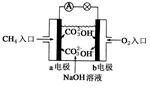
①电池的负极是__________(填“a”或“b”),该极的电极反应是:__________。
②电池工作一过程中正极pH______,负极pH值_______,一段时间后电解质溶液的pH__________(填“增大”、“减小”或“不变”)。
已知某溶液中只存在OH-、H+、NH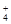 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH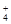 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(Cl-)>c(NH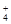 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH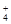 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH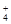 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_____________;若上述关系中④是正确的,则溶液中的溶质为____ ___。
(3)上述关系②是否正确:____________(填正确或不正确),_________________(正确则指明溶质,不正确 则说明原因)
则说明原因)
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)_______c(OH-)。
(5)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填图像符号)________________;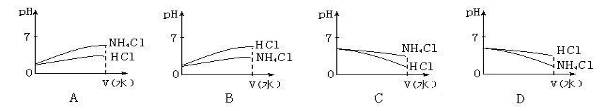
有均为1 mol/L的Na2CO3、FeCl3溶液,在Na2CO3溶液中滴入酚酞,则溶液呈现________(填“浅红”或“红色”,原因:__________________________(用离子方程表达),加热,则颜色变_________(浅或深),在FeCl3溶液中滴入石蕊,,则溶液呈现________(填颜色),若将其蒸干并灼烧,则得到的固体物质为:__________________________,若将饱和的FeCl3滴入沸水,则发生的反应: _________________________(用离子方程表达)
mol/L的Na2CO3、FeCl3溶液,在Na2CO3溶液中滴入酚酞,则溶液呈现________(填“浅红”或“红色”,原因:__________________________(用离子方程表达),加热,则颜色变_________(浅或深),在FeCl3溶液中滴入石蕊,,则溶液呈现________(填颜色),若将其蒸干并灼烧,则得到的固体物质为:__________________________,若将饱和的FeCl3滴入沸水,则发生的反应: _________________________(用离子方程表达)
Ⅰ.25℃时,①氢氟酸 ②醋酸 ③次氯酸的电离常数分别是3.5×10-4、
1.8×10-5、3.0×10-8。请推测:
(1)它们的酸性由强到弱的顺序为______________________(填序号,下同),
(2)相同浓度的溶液中,氢离子浓度最大的是__________,电离程度最小的是_______;
(3)相同浓度的④氟化钠溶液、⑤醋酸钠溶液、⑥次氯酸钠溶液pH的从大到小顺序:___________