原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W元素在周期表中的位置为 ;写出Y元素原子的价电子排布式: ;
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的分子属于 (填“极性”、“非极性”)分子。
(3)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g C气体(已知n(X):n(Y)=3:1)可放出18.44 kJ热量,则该反应的热化学方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物D
①已知1mol D能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下D与NaOH溶液反应的离子方程式 。
②又知D既能与盐酸反应,又能与氯水反应,写出D与氯水反应的离子方程式
。
(5)X的单质与Z的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,则M极的电极反应式为 。
五种短周期元素的部分性质数据如下:
| 元素 |
T |
X |
Y |
Z |
W |
| 原子半径(nm) |
0.037 |
0.075 |
0.099 |
0.102 |
0.143 |
| 最高或最低化合价 |
+1 |
+5 -3 |
+7 -1 |
+6 -2 |
+3 |
(1)Z离子的结构示意图为。
(2)关于Y、Z两种元素,下列叙述正确的是(填序号)。
a.简单离子的半径 Y > Z
b.气态氢化物的稳定性Y比 Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10 e-分子,乙是由Y、W两种元素形成的化合物。
某同学设计了下图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是。一段时间后,观察到试管中的现象是,发生反应的离子方程式是。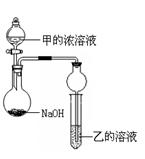
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被氢氧化钠溶液吸收的化学方程式是:2XO2 + 2NaOH =" M" + NaXO3 + H2O(已配平),产物M中元素X的化合价为。
有关FeSO4的转化关系如下图所示(无关物质已略去)。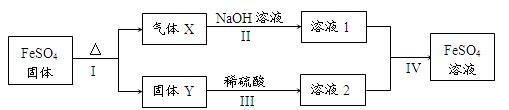
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式)。
(2)反应I的反应类型属于(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是。
现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。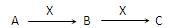
(1)若A由第三周期2种元素组成。常温下,0.1 mol/L X溶液的pH=13,则R在周
期表中的位置是,X中阴离子的电子式是,B转化为C的离子方程式是。
(2)若常温下A、B、C、X均为气态物质,1 mol A中含有共价键的数目约为1.806×1024, X为单质,A与X反应生成B的化学方程式是;在一定条件下,
A可与C反应消除C对大气的污染,该反应的化学方程式是。
氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为,CO的平衡转化率为。
常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;
④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号)。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是。