氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法正确的 是
是
| A.Fe2+、Mg2+、Cl-、NO3-能大量共存于pH =0的溶液中 |
| B.1L浓度为l mol·L-1的NH4Cl溶液中含有NA个NH4+ |
| C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO |
| D.不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性 |
氨跟氧化铜反应可以制备氮气2 NH3+3CuO
NH3+3CuO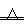


缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液量最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH稳定。已知在人体正常体温时,反应H2CO3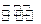 HCO3-+H+的Ka=10-6.1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,1g2=0.3。则下列判断正确的是()
HCO3-+H+的Ka=10-6.1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,1g2=0.3。则下列判断正确的是()
| A.正常人血液内Kw=10-14 |
B.由题给数据可算得正常人血液的pH约为7.4 |
| C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D.当过量的碱进入血液中时,只有发生HCO3-+OH=CO32-+H2O的反应 |
下列离子方程式正确的是()
| A.少量的钠跟足量盐酸反应:2Na+2H2O=2Na++2OH-+H2↑ |
| B.过量Cl2通向湿润的淀粉KI试纸,先变蓝后褪去:Cl2+2I-=2Cl-+I2 |
| C.Ba(HCO3)2溶液与Ba(OH)2溶液任意比混合:Ba2++HCO3-+OH-=BaCO3↓+H2O |
D.向浓HNO3溶液中加入足量的 铁粉:Fe+2NO3-+4H+=Fe2++2NO2↑+2H2O 铁粉:Fe+2NO3-+4H+=Fe2++2NO2↑+2H2O |
下图是一种由苄叉丙酮合成肉桂酸的工业流程。下列有关说法正确的是()
| A.反应I的实质是有机物发生还原反应 |
| B.肉桂酸分子中的所有碳原子一定在同一平面上 |
C.苄叉丙酮在一定条件下可以合成高分子 化合物 化合物 |
| D.反应II先加入还原剂的目的是要还原反应体系中的有机物 |
下列有关实验的操作、原理和现象,正确的是()
| A.吸滤操作可加快过滤速度,若吸滤完毕,则应先关闭水龙头,然后拆下连接抽气泵和吸滤液的橡皮管 | |
| B.某无色溶液中滴加硝酸银溶液,有白色沉淀生成, 加稀硝酸后沉淀溶解;若另取该溶液加稀硫酸后,微热后有气泡产生;可确定该溶液中一定含NO2- |
C.在纸层析法分离Fe3+和Cu2+的实验中,层析后,经氨熏,滤纸中无色带出现,一定是误将试样点浸没在展开试中 |
| D.结晶时,若沉淀的结晶颗粒较大,静置后容易沉降到容器底部,此时,进行分离的操作方法是倾析 |