C60是60个碳原子形成的封闭笼状分子,形似足球 ,它与石墨互为( )
,它与石墨互为( )
| A.同位素 | B.同素异形体 | C.同分异构体 | D.同一物质 |
下列叙述正确的是( )
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
| C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-=2H2O |
| D.工业冶炼金属铝的方法是电解熔融的氯化铝 |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO)>c(CO)>c(H2CO3) |
| C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+) |
| D.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合: |
c(Na+) =c(CH3COO-)+c(CH3COOH)
下列有关溶液的叙述中,正确的是()
| A.中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 |
| B.常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C.常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是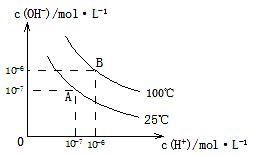
| A.100 ℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7 |
| B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/LHCl溶液等体积混合,所得溶液的pH等于7 |
| C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH等于7 |
| D.25 ℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
下列说法错误的是()
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO )+c(HCO
)+c(HCO )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
| A.② | B.②⑤ | C.①③ | D.②④ |