已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
某学生的实验报告所列出的下列数据中合理的是( )
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL |
| C.用广泛pH试纸测得某溶液的pH为2.3 |
| D.用托盘天平称量25.20g NaCl |
能判断某酸一定是弱电解质的是 ( )
| A.该酸易挥发 | B.该酸的稀溶液中有一种分子存在 |
| C.导电能力比盐酸弱 | D.0.1mol/L的该酸溶液中c(H+)为0.001mol/L |
下列电离方程式中,书写正确的是 ( )
| A.Cu(OH)2=Cu2+ + 2 OH- | B.NH3·H2O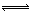 NH4+ + OH- NH4+ + OH- |
| C.HF= H+ + F- | D.H3PO4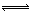 3 H+ + PO43- 3 H+ + PO43- |
一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
| A.c1∶c2=1∶3 | B.平衡时,Y和Z的生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1<0.14 mol·L-1 |
在一定温度下的密闭容器中存在如下反应:2SO2+O2 2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
| A.向正反应方向进行 | B.向逆反应方向进行 | C.达到平衡状态 | D.无法判断 |