可逆反应: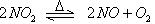 在固定体积的密闭容器中反应,达到平衡状态的标志是( )
在固定体积的密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成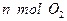 的同时生成
的同时生成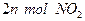
(2)单位时间内生成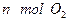 的同时,生成
的同时,生成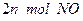
(3)用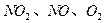 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的密度不再改变的状态
(6)混合气体的平均相对分子质量不再改变的状态
| A.(1)(4)(6) | B.(2)(3)(5) |
| C.(1)(3)(4) | D.(1)(2)(3)(4)(5)(6) |
在10 ℃时,某化学反应速率为0.1 mol·L-1·s-1,若温度每升高10 ℃,反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol·L-1·s-1,则该反应需在什么温度下进行( )
| A.30 ℃ | B.40 ℃ | C.50 ℃ | D.60 ℃ |
如右图中的曲线是表示其他条件一定时,2NO+O2 2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
| A.a | B.b | C.c | D.d |
已知:H2(g) + I2(g) 2HI(g)的平衡常数为K1;1/2 H2(g)+ 1/2 I2(g)
2HI(g)的平衡常数为K1;1/2 H2(g)+ 1/2 I2(g) HI(g)的平衡常数为K2,则K1、K2的关系为()。
HI(g)的平衡常数为K2,则K1、K2的关系为()。
| A.K1= 2K2 | B.K1= K22 | C.K1 = K2 | D.2K1= K2 |
已知:(1)H2(g)+1/2O2(g)  H2O(g) ΔH1=a kJ·mol-1
H2O(g) ΔH1=a kJ·mol-1
(2)2H2(g)+O2(g)  2H2O(g) ΔH2=b kJ·mol-1
2H2O(g) ΔH2=b kJ·mol-1
(3)H2(g)+1/2O2(g)  H2O(l) ΔH3=c kJ·mol-1
H2O(l) ΔH3=c kJ·mol-1
(4)2H2(g)+O2(g)  2H2O(l) ΔH4=d kJ·mol-1
2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
| A.a<c | B.d>0 | C.2a=b<0 | D.2c=d>0 |
对于可逆反应A(g)+B(g) C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )