某有机物在氧气中充分燃烧生成的水和二氧化碳的物质的量比为1︰1,由此可得出结论是( )
| A.该有机物分子中碳、氢、氧原子个数比为1︰2︰3 | B.该有机物中必含氧元素 |
| C.该有机物分子中碳、氢原子个数比为1︰2 | D.该有机物中必定不含氧元素 |
有关下图及实验的描述正确的是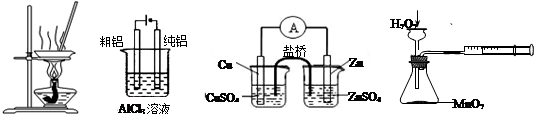
图1图2图3图4
| A.用图1装置蒸发FeCl3溶液制备无水FeCl3 |
| B.用图2装置电解精炼铝 |
| C.用图3装置构成铜锌原电池 |
| D.用图4装置定量测定化学反应速率 |
已知反应①:CO(g)+CuO(s)⇌CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)⇌Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
A.反应①的平衡常数K1=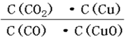 |
B.反应③的平衡常数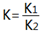 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应 |
| D.对于反应②,恒温恒容下,增大压强,H2浓度一定增大 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说明不正确的是
A.在冰醋酸中,高氯酸的酸性最强
B.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
C.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
D.在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42-
下列说法正确的是
A.一定条件反应:2CO(g)  CO2(g)+C(s)可自发进行,则该反应的△H>0 CO2(g)+C(s)可自发进行,则该反应的△H>0 |
| B.向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明硫酸亚铁溶液已变质 |
| C.升高CH3COONa溶液温度,其水的离子积常数和PH值都增大 |
| D.相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl ③NH3·H2O,水电离程度由大到小的顺序是:①>②>③ |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是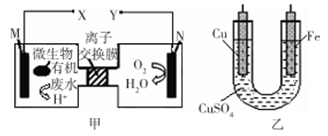
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
| C.M电极反应式:(C6H10O5)n + 7nH2O-24ne-= 6nCO2↑+ 24nH+ |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |