在理论上可用于设计原电池的化学反应是
| A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(aq)+3H2(g);△H <O |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0 |
| C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0 |
D.FeCl3(aq)十3H2O(1)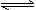 Fe(OH)3(s)+3HCl(aq);△H >0 Fe(OH)3(s)+3HCl(aq);△H >0 |
下列反应的离子方程式正确的是
| A.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O |
| B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| C.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合: 2AlO2-+5H+= Al(OH)3↓+Al3++H2O |
| D.向硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
现有t℃时质量分数为a %的KNO3溶液m g,将其分成质量比为1∶2的甲、乙两份溶液。甲溶液蒸发5 g水,恢复到原温度时析出晶体2 g;乙溶液蒸发12 g水,恢复到原温度时析出晶体5 g。则t℃时,KNO3溶解度为
| A.41.7 g | B.50 g | C.40 g | D.60 g |
下列对进行焰色反应实验操作注意事项的说明正确的是①要透过蓝色的钴玻璃观察钾的火焰颜色②先把铂丝烧到与原来火焰颜色相同,再蘸取被检测的物质③每次实验后,要用盐酸把铂丝洗净④实验时最好选择本身较微弱的火焰⑤没有铂丝,也可以用光洁无锈的铁丝代替
| A.仅有③不正确 | B.仅有④不正确 | C.仅有⑤不正确 | D.全对 |
某结晶水合物的化学式为A·nH2O,其相对分子质量为M,在25℃时,a g晶体溶于b g水中即达饱和,形成密度为ρg/mL的溶液,下列表达式正确的是
| A.饱和溶液的物质的量浓度为:1000a(M-18n)/M(a+b)mol/L |
| B.饱和溶液中溶质的质量分数为:100a(M-18n)/M(a+b)% |
| C.饱和溶液的体积为:(a+b)/ρL |
| D.25℃时,A的溶解度为:a(M-18n)/(bM+18an)g |
某学生在实验室制Cl2时可能进行如下操作:①连接好装置,检查气密性;②缓缓加热;③加入MnO2粉末;④从装有浓盐酸的分液漏斗中向烧瓶里滴加浓盐酸;⑤多余的Cl2用NaOH溶液吸收;⑥用向上排空气法收集Cl2.其中正确的操作顺序是
| A.①②③④⑤⑥ | B.①③④②⑥⑤ | C.①④③②⑥⑤ | D.③④②①⑥⑤ |