工业上由二氧化锰制备高锰酸钾可以分两步进行
①MnO2与KOH共熔并通入O2:2MnO2+4KOH+O2 2K2MnO4+2H2O
|
②电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
下列叙述正确的是:
| A.氧化性:K2MnO4>KMnO4>O2 |
| B.第②步电解时,KMnO4在阳极区生成 |
| C.第②步电解时,阴极周围溶液pH减小 |
| D.每生成1mol KMnO4共转移6mole- |
为了证明液溴与苯发生的反应是取代反应,有如下图所示的装置。则装置A中盛有的物质是( )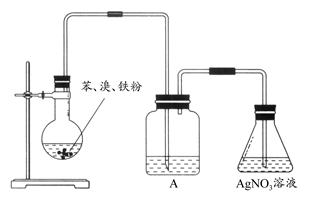
| A.水 | B.NaOH溶液 | C.CCl4 | D.NaI溶液 |
某有机物的结构简式为:
下列说法不正确的是( )
| A.该有机物属于饱和烷烃 |
| B.该烃的名称是3甲基5乙基庚烷 |
| C.该烃与2,5二甲基3乙基乙烷互为同系物 |
| D.该烃的一氯取代产物共有8种 |
含有2~5个碳原子的直链烷烃的沸点和燃烧热的数据见下表:
| 烷烃名称 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
| 沸点(°C) |
-88.6 |
-42.1 |
-0.5 |
36.1 |
| 燃烧热(kJ·mol-1) |
1560.7 |
2219.2 |
2877.6 |
3535.6 |
根据表中数据,下列判断错误的是( )
A.正庚烷在常温、常压下肯定不是气体
B.烷烃的燃烧热和其所含碳原子数基本呈线性关系
C.随碳原子数增加,烷烃的沸点逐渐升高
D.随碳原子数增加,烷烃的沸点和燃烧热都成比例增加
某主链为4个碳原子的单烯烃共有4种同分异构体,则与这种单烯烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有同分异构体( )
| A.2种 | B.3种 | C.4种 | D.5种 |
近年来,科学家在海洋中发现了一种冰状物质——可燃冰,其主要成分为甲烷,下列说法正确的是( )
①甲烷属于烃类 ②在相同条件下甲烷的密度大于空气 ③甲烷难溶于水 ④可燃冰是一种极具潜力的能源
| A.①③④ | B.②③④ | C.①②③ | D.①②④ |