(15分)
阅读分析材料,据此完成下列要求。
工业纯碱中常含有少量的NaCl和NaOH。某校课外活动小组的同学为测定纯碱样品中
Na2CO3的质量分数,选择下列适当装置进行连接,并对设计方案不断完善,成功完成了
测定实验。
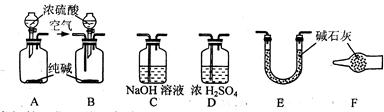 |
⑴活动小组的五位同学对实验装置的设计进行了讨论发言,内容如下:
甲:将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,分别测量反应前和反应后E的总质量,就可求出Na2CO3的质量分数。
乙:还应在A和E之间连接装置 (填序号),其目的是 。
丙:应该用B装置取代A装置。从B装置的导管口处缓慢鼓入空气,其目的是 。
丁:若直接向B装置中鼓入空气会导致实验测定结果 (填“偏高”、“偏低”或
“无影响”),因此,应将鼓入的空气先通过装置 (填序号)。
戊:E装置后还应连接装置F,其作用是 。
⑵学生课外活动小组测定的数据如下,计算该工业纯碱中Na2CO3的质量分数为 。
| 工业纯碱样品质量 |
反应前E的总质量 |
反应后E的总质量 |
| 6.4g |
51.9g |
54.1g |
⑶简述实验室测定上述样品中Na2CO3的质量分数的另一种方法(含实验仪器、实验步骤、实验现象) 。
1—20号中的某几种元素微粒的电子层结构均为 ,根据下列叙述,填写相应的微粒符号:
,根据下列叙述,填写相应的微粒符号:
(1)A微粒一般不与其他物质发生反应,则A为_____________________________。
(2)B微粒所在的元素是地壳中含量最多的,则B为__________________________。
(3)C微粒氧化性很弱,但获得一个电子后形成的电中性的原子则还原性很强,则C为_____。
(4)D微粒与H+相结合形成的化合物,能腐蚀玻璃,则D为____________________。
写出下列四种粒子的符号并画出结构示意图:
(1)原子核外最外层电子数是次外层电子数3倍的原子__________________________。
(2)原子核外有三个电子层,最外层有7个电子的原子__________________________。
(3)相对原子质量为23,中子数为12的带1个单位正电荷的离子______________________。
(4)原子核外有35个电子的原子__________________________。
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试完成下列问题:
(1)写出五种元素的元素符号:A__________,B__________,C__________,D__________,E__________。
(2)用电子式表示离子化合物A2B的形式过程:____________________________。
(3)写出下列物质的电子式:
①D元素形成的单质____________________;
②E与C形成的化合物____________________;
③A、B、E形成的化合物____________________;
④D与E形成的化合物____________________。
在下列转化关系中,已知D是短周期元素形成的单质,其他物质均是化合物,且A的相对分子质量小于B的相对分子质量。
根据以上物质间的转化关系(图中略去了转化中的部分物质):
(1)写出D、X、Y的化学式D:___________,X:___________,Y:___________。
(2)写出Z的电子式:___________,Z属于___________化合物(填“离子”或“共价”)。
(3)化学物C中含有的化学键类型为___________。
短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子后被还原为中性原子,0.4 克A的氧化物恰好与100 mL 0.2 mol·L-1的盐酸完全反应,A元素原子核内质子数与中子数相等;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请完成下列问题:
(1)推断A、B、C、D四种元素的符号:
A_______________;B_______________;C_______________;D_______________。
(2)C的原子结构示意图____________________________。
(3)D元素的最高价氧化物的结构式是________________。
(4)C、D元素组成的物质,分子内含有____________(填“极性”或“非极性”)键,其分子为______________(填“极性”或“非极性”)分子。
(5)用电子式表示A、C两元素形成化合物的过程:____________________________。