氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: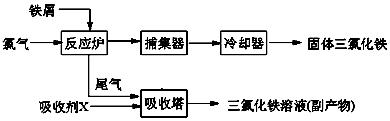
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为: 。
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(5)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为: 。
③某同学根据上述方案,使用上述(2)中获得的FeCl3·6H2O样品代替无水氯化铁样品进行测定。通过计算发现产品中的质量分数大于100%,其原因可能是 。
[化学一选修3:物质结构与性质](15分)A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为;D和E的电负性大小关系为(用元素符号表示)。
(2)化合物E2D分子的空间构型为,中心原子采用杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为,任意写出一种它的等电子体的化学式为。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于晶体,晶体内含有的作用力类型有。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为g/cm3。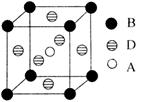
[化学一选修2:化学与技术](15分)随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: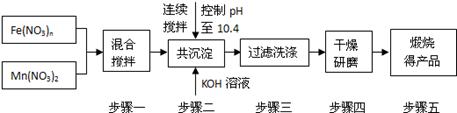
(1)原料Fe(NO3)n中n=,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为。
(2)步骤二中“连续搅拌”的目的是;步骤三中洗涤干净的标准是。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4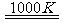 MnFe2O4-x+
MnFe2O4-x+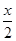 O2↑
O2↑
MnFe2O4+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为。
②该热化学循环法制氢的优点有(答两点即可) 。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是。
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
(1)A所含元素在周期表中的位置为,C的电子式为。
(2)A与H在加热条件下反应的化学方程式为。
(3)25℃时,pH均为10的H和G溶液,由水电离出的c(OH-)之比为。
(4)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为。
(5)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=。
为了充分利用铜资源,某工厂拟用黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如下:
(1)滤渣1的主要成分为____。稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的反应的离子方程式是 。
(2)滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是____,实验室通常用____溶液吸收。
(3)稀硫酸通过浓硫酸稀释得到,稀释浓硫酸的正确操作方法是____。过滤操作所需玻璃仪器除玻璃棒外还有____。
(4)用惰性电极电解滤液4可制取金属铜,若制得金属铜12.8 g,则同时阳极得到_____L气体(标准状况)。
X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
元素周期表中核电荷数最小的元素 |
| Y |
Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z |
Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W |
W是地壳中含量最高的金属元素 |
| M |
常见金属,单质呈紫红色 |
(1)W位于元素周期表第周期第 族;W的简单离子半径比Z的简单离子半径(填“大”或“小”)。
(2)Z原子的第一电离能比氧原子的(填“大”或“小”);M的基态原子价电子排布式是
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是,空间构型是
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途: 、;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:____。
(5)可用YX4还原ZOx以消除其污染。已知:
YX4 (g) +4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g) +2X2O(g) △H =" -" 1160 kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:____。