甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。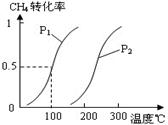
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H 0,△S 0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
| ⅰ |
150 |
1/3 |
0.1 |
| ⅱ |
|
|
5 |
| ⅲ |
350 |
|
5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
天宫一号(Tiangong-1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步。天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C ="=" K2S + N2 ↑+ 3CO2 ↑。
①写出K2S的电子式:;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢 加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
;
实验 二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,
二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量, 一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:;
一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:;
(2) 1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:;
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏 二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为;
二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为;
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该 物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子
物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子 方程式:;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱
方程式:;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱 反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:。
反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:。
在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化.
(1)先出现红褐色沉淀,原因是__________________________________.
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式____________________________.
(3)最后溶液颜色加深,此原因的反应 的离子方程式是________________________
的离子方程式是________________________
(10分)(1)已知下列变化过程中,0.2 mol R2O72-与0.2 mol K2SO3恰好反应,则R被还原的价态为____。
(2)在100 mL 0.100 mol·L-1的FeBr2溶液中通入Cl2,若要使Fe2+刚好反应完全,则需标准状况下C l2________ mL。
l2________ mL。
(3)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
①已知KBrO3在反应中得到电子,则该反应的还原剂是______________________.
②已知0.2 mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
10.4gR2SO4中含0. 1molR2+,则R2SO4的摩尔质量是;R的相对原子质量是。
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是。
(2)方案二:按下图装置进行实验。并回答以下问题:
①实验前应先________________。分液漏斗中应该装___________(填“盐酸”或“稀硫酸盐”)。D装置的作用是_________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。