T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是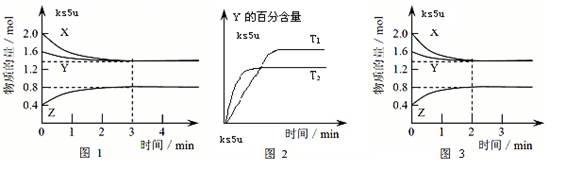
A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g) 2Z(g) |
| B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
设NA为阿伏加德罗常数,下列叙述中,正确的是
| A.标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA |
| B.7g CnH2n中含氢原子数为NA |
| C.78 g 过氧化钠与CO2反应,转移电子数为2NA |
| D.25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA |
下列关于能源的说法不正确的是
| A.煤的干馏是物理变化,煤的气化和液化是化学变化 |
| B.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| C.沼气(主要成分是CH4)是可再生能源 |
| D.太阳能、氢能、风能、地热能、生物质能都是新能源 |
分类是科学研究的重要方法,下列物质属于电解质的是
| A.Cu | B.CO2 | C.冰醋酸 | D.氨水 |
常温下,下列溶液中的粒子浓度关系正确的是
| A.NH4Cl溶液中:c(Cl-)=c(NH4+) >c(OH-)=c(H+) |
| B.Na2SO4溶液中:c(Na+)+ c(H+)=c(SO42-) + c(OH-) |
| C.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| D.浓度均为0.1mol·L-1CH3COOH与CH3COONa溶液等体积混合:2c(H+)-2c(OH-)="c" (CH3COO-)-c(CH3COOH) |
下列选项中的原因或结论与现象不对应的是
| 选项 |
现象 |
原因或结论 |
| A |
在 H2O2中加入MnO2,能加速H2O2的分解速率 |
MnO2降低了反应所需的活化能 |
| B |
向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1KSCN溶液,溶液颜色加深 |
增大反应物浓度,平衡向正反应方向移动 |
| C |
将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 |
该反应△H<0,平衡向生成NO2方向移动 |
| D |
在密闭容器中有反应:A+xB(g) 2C(g)。达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1 2C(g)。达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1 |
A非气体、x=1 |