下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:请回答下列问题: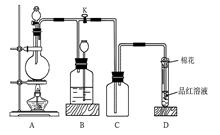
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为__________。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是________,其作用是_________________。
(3)装置B的作用是贮存多余的二氧化硫和防止其污 染环境,则B中应盛放的液体是(填写字母代号)________;
a.水 b.浓溴水; c.KMnO4酸性溶液 d.NaHSO3饱和溶液
(4)收集二氧化硫完毕,应进行的操作为:________________________________。
(5)若用该套的A、B、C装置制备H2S,则B中应加入的最合理的液体是____________。
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| 实验操作 |
实验现象 |
|
| I |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色。 |
| II |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是。
(2)实验操作II吹入热空气的目的是。
(3)装置C的作用是,C中盛放的药品是。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式。
(5)由上述实验得出的结论是。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
。
某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。
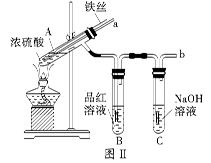
请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
| 步骤 |
所选试剂 |
现象及结论 |
| 1 |
||
| 2 |
||
| 3 |
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃。某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去)。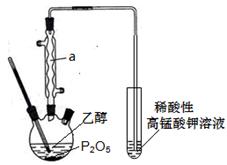

(1)仪器a的名称为_________________
(2)用化学反应方程式表示上述制备乙烯的原理______________________________。
(3)已知P2O5是一种酸性干燥剂,吸水放大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为 )__________________________________。
)__________________________________。
(4)某同学认为用上述装置验证产生了乙烯不够严密,理由是___________________。
(5)某同学查文献得知:40%的乙烯利(分子式为C2H6ClO3P)溶液和NaOH固体混和可快速产生水果催熟用的乙烯,请在上述虚线框内画出用乙烯利溶液和NaOH固体制取乙烯的装置简图(夹持仪器略)。
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
能安静燃烧、产生淡蓝色火焰 |
气体成分为______ |
| 实验Ⅲ |
取实验I中的白色不溶物,洗涤,加入足量 |
|
白色不溶物可能含有MgCO3 |
| 实验Ⅳ |
取实验I中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀 |
溶液中存在④离子 |
(3)为进一步确定实验I的产物,设计定量实验方案,如图所示:
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因_________。