(15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92kJ(填“大于”、“等于”或“小于”) ,原因是
,原因是
;若加入催化剂,ΔH (填“变大”、“变小”或“不变”)。
(2)下列有关合成氨反应速率的叙述,不正确的是 (选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N N键、1mol H
N键、1mol H H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N H键需要吸收的能量为 kJ。
H键需要吸收的能量为 kJ。
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物。
发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g)  ΔH1=+67.7 kJ/mol
ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
则:1mol N2H4完全反应的热化学方程式为 。
煤的气化过程中发生反应:CO(g)+H2O(g)  CO2(g)+H2(g),若在恒温压容器中充入1 mol CO和3 mol 水蒸气发生上述反应,达到平衡时测得反应物与生成物的物质的量之比为5∶3,且吸收热量180 kJ,请回答下列问题:
CO2(g)+H2(g),若在恒温压容器中充入1 mol CO和3 mol 水蒸气发生上述反应,达到平衡时测得反应物与生成物的物质的量之比为5∶3,且吸收热量180 kJ,请回答下列问题:
(1)该反应的热化学方程式可写为。
(2)两种反应物的转化率之和为。
(3)该条件下此反应的平衡常数为。
(4)若要在相同的温度下和相同的容器中,按下列物料配比充入,建立平衡后CO的体积百分含量与题干平衡相同,下列选项中可行的是。
| 物质 选项 |
n(CO) |
n(H2O) |
n(CO2) |
n(H2) |
| A |
0 mol |
4 mol |
2 mol |
2 mol |
| B |
0.5 mol |
2.5 mol |
0.5 mol |
0.5 mol |
| C |
1 mol |
4 mol |
0.5 mol |
0.5 mol |
| D |
0 mol |
0 mol |
1 mol |
3 mol |
(5)若要在相同的温度下和相同的容器中,充入下列物料建立平衡,平衡后CO2的体积分数与题干平衡的CO2的体积分数相同,但CO的体积分数与题干平衡中CO的体积分数不同的是。
| 物质 选项 |
n(CO) |
n(H2O) |
n(CO2) |
n(H2) |
| A |
0 mol |
0 mol |
1 mol |
3 mol |
| B |
2.5 mol |
0.5 mol |
0.5 mol |
0.5 mol |
| C |
3 mol |
1 mol |
0 mol |
0 mol |
| D |
0 mol |
0 mol |
3 mol |
1 mol |
【化学选修——有机基础化学】
醋柳酯是一种镇咳祛痰药,用于上呼吸道感染、感冒咳嗽、急慢性支气管炎症等的治疗,其结构简式如图。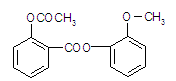
回答下列问题:
(1)醋柳酯的分子式为。
(2)关于醋柳酯的说法中,正确的是()
| A.是高分子化合物 |
| B.可与氢气发生加成反应 |
| C.不能发生银镜反应 |
| D.能发生水解反应且只生成2种有机物 |
(3)醋柳酯可由下图所示路线合成: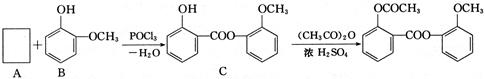
①A的含氧官能团名称为;中间产品C中混有反应物A和B,检验C中含有A的试剂是。
②由C制醋柳酯的反应类型为;写出C和足量NaOH溶液反应的化学方程式。
③A的同分异构体很多,写出一种属于酯类、且能与FeCl3溶液反应显紫色的同分异构体的结构简式。
【化学—物质结构与性质】
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):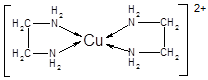
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为,H、N、O三种元素的电负性由大到小的顺序是;
(2)SO2分子的空间构型为;
(3)乙二胺分子中氮原子轨道的杂化类型为,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是。
(4)配离子[Cu(En)2]2+的配位数为,该微粒含有的微粒间的作用力类型有(填字母);
| A.配位键 |
| B.极性键 |
| C.离子键 |
| D.非极性键 |
E.氢键
F.金属键
(5)CuCl的晶胞结构如图所示,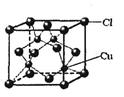
其中Cl-的配位数(即与Cl- 最近距离的Cu+的个数)为。
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下: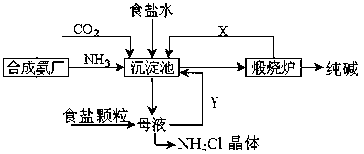
(1)完成有关反应的化学方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。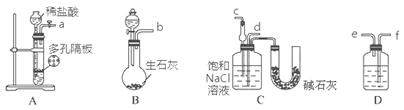
(3)上述装置中接口连接顺序为;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为。
铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH ="=" 2Na2FeO4 + 3X + 5H2O, 则X的化学式,反应中被氧化。
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: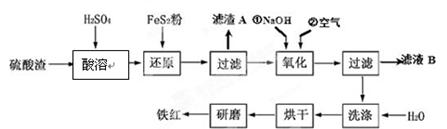
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;
“滤渣A”主要成份的化学式为。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O ="=" 15Fe2 + + SO42-+ 。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为。
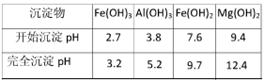
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)。