某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。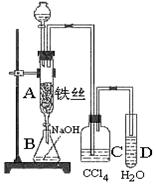
(1)写出A中反应的化学方程式: 。
(2)观察到A中的现象是 。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
(安徽省芜湖市一中2008届高三第二次模拟考试,化学,16)下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒(b)容量瓶(c)滴定管(d)托盘天平(e)温度计
(1)其中标示出仪器使用温度的是(填写编号)
(2)由于操作错误,使得到的数据比正确数据偏小的是(填写编号)
A.实验室制乙烯测量混合液温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为g。
Ⅰ.化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)。
Ⅱ.实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:。
(2)硫酸溶液过稀会导致。
(3)采用水浴加热的原因是。
(4)反应时铁屑过量的目的是(用离子方程式表示)。
(5)溶液趁热过滤的原因是塞紧试管口的目的是
(6)静置冷却一段时间后,在试管中观察到的现象是。
如图学习小组甲、乙所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,B中装有Cu或CuO(用石棉绒作载体),C中装的是蒸馏水。请回答下列问题: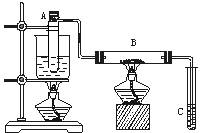

甲乙
⑴甲中B内放置的是; 乙中B内放置的是。
乙向试管A中鼓入空气的目的是_____________________。
⑵甲乙装置中A试管为什么都要水域加热:。
⑶甲中玻璃管中可观察到的现象是_____________________;
甲和乙中反应的化学方程式分别是_______________________;
。
⑷在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是_______________________。
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高。观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH值的变化如右图曲线关系。请回答下列问题:
①电解前氯化铜溶液的pH值处于A点位置的原因是:(用离子方程式说明)。
②“理论派”所持观点的理论依据是:。
③“实验派”的实验结论是 ,他们所述“精确实验”是通过
确定的。
④你持何种观点?你所持观点的理由是(从化学原理加以简述)。
某固体混合物可能含有
、
、
、
和
,将该混合物进行如下实验,根据所给实验现象完成表格(对于可能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填"无")。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
| 1. |
(1)将少许固体放入水中得到无色溶液和白色沉淀。
|
| 2. |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
| 3. |
(4)通过上述实验仍无法确定的物质是 |