温度为T0时,在容积固定的密闭容器中发生反应,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是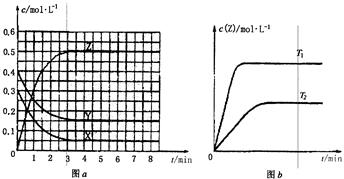
| A.该反应的正反应是放热反应 |
| B.起始时若X、Y的浓度变为原来的2倍,建立的平衡状态与原平衡不等效 |
| C.图a中反应达到平衡时,Y的转化率为37.5% |
D.反应时各物质的反应速率关系为: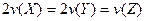 |
将50mL 物质的量浓度为12mol/L的盐酸(密度为1.19g/cm3)稀释成6mol/L的盐酸(密度为1.10g/cm3),需加水(密度为4℃时的测量值)的体积为
| A.50mL | B.50.5mL | C.55mL | D.59.5mL |
用硫酸铜晶体配制500mL0.1mol/L的硫酸铜溶液,需要硫酸铜晶体的质量为
| A.25g | B.12.5g | C.6.25g | D.37.5g |
下列数量的各物质所含原子总数按由大到小顺序排列的是
①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸
| A.①④③② | B.④③②① | C.②③④① | D.①②④③ |
下列说法正确的是
| A.如果5.6LN2含有n个氮分子,则NA一定约为4n |
| B.18g水中所含的电子数是8NA |
| C.在100mL0.5mol/L盐酸溶液中含有氯化氢分子数为0.05 NA |
| D.23g Na+含有10mol电子 |
用98%的浓硫酸(密度为1.84g·cm-3)配制1mol·L-1的稀硫酸100mL。配制过程中可能使用到下列仪器:①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管⑦玻璃棒。按先后顺序排列正确的是
| A.④③⑦⑤⑥ | B.②⑤⑦④⑥ | C.④③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |