惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
试回答下列问题:
(1)A的结构简式为 ;F的结构简式为 。
(2)反应②中另加的试剂是 ;反应⑤的一般条件是 。
(3)反应③的化学方程式为 。
(4)上述合成路线中属于取代反应的是 (填编号)。
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。
(1)b电极材料应为____,电极反应式为________________。
(2)电解液C可以是__________。
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
(1)该反应450℃时的平衡常数500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0. 10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则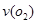 =mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡移动(填“向正反应方向”、“向逆反应方向” 或“不”)
=mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡移动(填“向正反应方向”、“向逆反应方向” 或“不”)
在一定条件下,反应x A+YB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,则该反应的平衡常数表达式为_______________________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是___________;
(3)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动
已知可逆反应CO+H2O(g)  CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=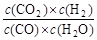 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为;K值为。
(2)830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。
在X极附近观察到的现象是。
②Y电极上的电极反应式为,
检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是。
②Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)